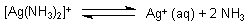
Die Stabilitätskonstante
Experimente:
Versuch: Elektrochemische Bestimmung der Stabilitätskonstante von
Diamminsilber(I)
Liganden und Zentralteilchen stehen mit der Komplexeinheit in einem Dissoziationsgleichgewicht.
Zum Beispiel bildet Diamminsilber(I) in wässriger Lösung Silber-Ionen und Ammoniakmoleküle.
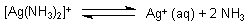
(Genau genommen verdrängen Wassermoleküle schrittweise die zuvor gebundenen Ammoniakmoleküle. Das wollen wir hier aber nicht berücksichtigen.)
Das Gleichgewicht beschreibt die Dissoziationskonstante (Dimension mol/l).
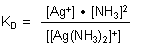
Von Interesse ist aber meistens die Bildungsreaktion des Komplexes.
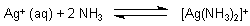
Die zugehörige Gleichgewichtskonstante wird als Komplexbildungskonstante (Dimension l/mol) bezeichnet. Sie ist der Kehrwert der Dissoziationskonstante.
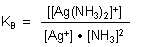
Diese gibt Aufschluss über die Stabilität des Komplexes und wird deshalb auch als Stabilitätskonstante des Komplexes bezeichnet.
Wenn man nun wissen will, ob ein Komplex stabiler ist als ein anderer, muss man nur einen Blick auf ihre
Stabilitätskonstanten werfen:
Je größer der Wert der Konstante ist, desto stabiler ist auch der Komplex.
Das gilt natürlich nur, wenn die Konstanten überhaupt vergleichbar sind. Das ist dann gegeben, wenn es
sich um die gleichen Liganden handelt oder wenn die Maßeinheiten gleich sind, also zum Beispiel mol/l
oder mol6/l6.
Die Werte in der folgenden Tabelle sind die des Gesamtkomplexes. Sie sind aus den einzelnen
Komplexbildungskonstanten zusammengesetzt. Will man echte Vergleiche ziehen, so muss man die Werte der
einzelnen Gleichgewichte nehmen.
Ein Beispiel hierfür ist das Hämoglobin, das - bei ansonsten gleicher Ligandenanordnung - normalerweise
O2 bindet, jedoch leider auch CO anlagern kann. Das Verhältnis der Stabilitätskonstanten von Hb/CO
zu Hb/O2 ist 325 : 1. Das heißt, dass sich CO 325 mal stärker bindet als Sauerstoff - mit all
seinen gesundheitlichen Folgen. Dieser Wert ist im Sinne des oben angeführten Merksatzes und der erwähnten
Einschränkungen wirklich aussagekräftig.
| Komplex | KB |
| [Co(NH3)4]2+ | 105 mol-4 · l4 |
| [Ag(NH3)2]+ | 107 mol-2 · l2 |
| [Ni(NH3)6]2+ | 109 mol-6 · l6 |
| [Cu(NH3)6]2+ | 1013 mol-6 · l6 |
| [Mg(edta)]2+ | 108 mol-1 · l |
| [Ca(edta)]2- | 1011 mol-1 · l |
| [Ni(en)3]2+ | 1012 mol-3 · l3 |
| [Ag(S2O3)2]3- | 1013 mol-2 · l2 |
| [Fe(CN)6]4- | 1037 mol-6 · l6 |
| [Fe(CN)6]3- | 1044 mol-6 · l6 |
Weitere Texte zum Thema „Komplexverbindungen“