 |
| Bild 1: Chromkristalle. Du erkennst
deutlich die kubische Kristallform
(Foto: Daggi) |
Metallgitter
Experimente:
Versuch: Einfache Experimente zu den Eigenschaften von Metallen
Versuch: Kupferpulver lässt sich in der Kälte zu
Blech verformen
Versuch: Bleibaum
Versuch: Glitzernde Silberkristalle
Versuch: Zinngeschrei und Schwefelknistern
Die meisten Elemente sind Metalle. Metallgewinnung und -verarbeitung haben für den Menschen
von jeher eine große Rolle gespielt. Denn ohne Metalle sind moderne Technik und Kultur
nicht vorstellbar. Besonders gute Verformbarkeit der Metalle (z. B. durch Schmieden, Pressen,
Walzen oder Ziehen) und ihre Festigkeit haben sie für den Menschen als Werkstoffe
unentbehrlich gemacht.
Die meisten metallischen Werkstoffe sind jedoch keine reinen Metalle, sondern
Legierungen.
Denn reine Metalle sind oftmals zu weich und deshalb die Ausnahme.
Legierungen sind Metallmischungen, die aus mindestens zwei unterschiedlichen Metallen
bestehen. Die Zahl der gebräuchlichen Legierungen ist inzwischen unübersehbar groß
geworden. Denn durch Art und Menge der zum Grundmetall hinzugefügten Legierungsmetalle
lassen sich ihre Eigenschaften (z. B. Härte, Dehnbarkeit, elektrische Leitfähigkeit,
Rostfreiheit) praktisch jedem gewünschten Zweck anpassen. Vor allem Bronze und Stahl sind
Beispiele für wichtige Legierungen, die eine besondere Rolle in der Menschheit spielen bzw.
spielten.
Woran man ein Metall erkennt
Es gibt mehr als 80 verschiedene Metalle. Du erkennst Metalle sofort, denn sie haben
charakteristische gemeinsame Merkmale (vorausgesetzt, dass sie eine saubere Oberfläche
haben). Das kannst du lernen, wenn du den Versuch
durchführst.
|
1. Alle Metalle und Metallschmelzen zeigen den typischen, schönen metallischen Glanz.
|
Bei den Eigenschaften gibt es natürlich Abstufungen. Z. B. leiten manche Metalle wie Silber, Kupfer oder Aluminium den elektrischen Strom oder die Wärme besonders gut.
 |
| Bild 1: Chromkristalle. Du erkennst
deutlich die kubische Kristallform
(Foto: Daggi) |
Wie Metalle aufgebaut sind
Die gemeinsamen Eigenschaften der Metalle sind auf die gegenseitige Anordnung der Atome
und auf die Art der Bindung zwischen ihnen zurückzuführen. Hier gilt wieder einmal die
Aussage: Die Struktur, die die kleinsten Teilchen eines Stoffes aufbauen,
beeinflussen seine Eigenschaften.
Normale Metalle sind ein Gefüge aus mehr oder weniger großen Kristallen (Bilder 2
und 3). Diese Kristalle kann man manchmal sogar sehen. Das ist der Fall bei verzinktem Blech:
Hier überziehen die Zinkkristalle das Eisen wie Eisblumen das Fensterglas. Gleiches gilt
für die Verzinnung. Beim Zinn kann man ihr Aneinanderreiben sogar hören, wenn man den
Stab biegt ("Zinngeschrei"; Versuch).
Manche Metalle (wie das Zinn) kommen sogar in verschiedenen Modifikationen vor.
 |
| Bild 2: Feuerverzinktes Blech (Foto: Daggi) |
Metallkristalle kannst du selber herstellen. Dazu findest du in der obigen Liste der Experimente einige Tipps.
Wie Metallkristalle aufgebaut sind
Metallkristalle sind aus untereinander mehr oder weniger locker verbundenen, aber dicht
gepackten Metallatomen aufgebaut (Bild 2). Diese Metallatome sind regelmäßig angeordnet
und bilden große Schichten. Sie nehmen in diesem Metallkristall feste Plätze ein. Man
sagt, sie bilden ein Metallgitter.
Genau genommen liegen nicht mehr Metall-Atome vor, sondern ionenähnliche Teilchen
("Atomrümpfe"), die ein bis durchschnittlich 1,3 Valenzelektronen an die Umgebung abgegeben
haben. Im Kristall hat jedes Metallatom 12 (kubisch bzw. hexagonal dichteste Packung; siehe unten)
bzw. 8 nächste plus 6 etwas weiter entfernte Nachbarn (kubisch raumzentriert; siehe unten).
Damit fehlen für die Ausbildung von üblichen chemischen Bindungen zu den Nachbarn
Valenz-Elektronen (im Fall einer Ionenbildung) und Orbitale (im Fall einer Elektronenpaarbindung).
Die metallische Bindung beruht also nicht auf stöchiometrischen Gesetzmäßigkeiten.
Diese Elektronen können sich zwischen den Atomen bewegen. Sie bilden
eine Art "Elektronengas". Dieses ist der Grund
für die hohe elektrische Leitfähigkeit der Metalle. Aber auch die
Wärmeleitfähigkeit hat ihre Ursache darin. Denn die frei beweglichen Elektronen sind
hervorragende Wärmetransporteure.
Auf den frei beweglichen Elektronen beruht auch der metallische Glanz. Die Elektronen werden
durch Licht, also durch elektromagnetische Strahlung angeregt und strahlen das Licht gleich
wieder ab: Das macht sich als Reflexion bemerkbar.
Metallkristalle unterscheiden sich von Ionenkristallen in einigen wesentlichen Eigenschaften. Salzkristalle zerspringen sehr leicht, denn im Ionengitter kommen beim Verschieben der Schichten gegeneinander Ionen gleicher Ladung nebeneinander zu liegen, welche sich gegenseitig abstoßen. Im Metallgitter besitzen die Metallatome alle die gleiche Ladung, die Schichten lassen sich gegeneinander verschieben, ohne dass der Zusammenhalt verloren geht. Wenn du einen Metallstab verbiegst, kannst du sogar hören, wie sich einzelne Schichten gegeneinander verschieben (-> Versuch).
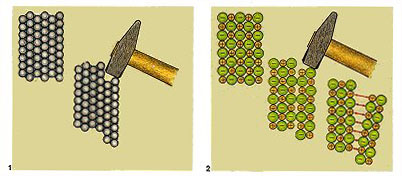 |
| Bild 3: Metallgitter und Ionengitter
im Vergleich
(Quelle: Cornelsen) |
Kristallmodelle von Metallen
Da die Metallgitter immer nur Teilchen einer Art enthalten, sind sie sehr einfach aufgebaut.
Betrachtet man einmal stark vereinfacht die Atome eines bestimmten Metalls als Kugeln
gleicher Größe und versucht, sie möglichst dicht aneinander zu packen, so zeigt
sich schnell, dass dies praktisch vor allem dadurch erreicht wird, indem die Kugeln einer
Schicht jeweils die Lücken der anderen besetzen. Du kannst das mit Tischtennisbällen oder Murmeln leicht
nachprüfen.
Um eine Grundstruktur einer solchen Atomanordnung nachzubauen, braucht man mindestens 14
gleich große Kugeln (z. B. Tischtennisbälle oder Holz- bzw. Zellstoffkugeln aus dem
Bastelladen). Solch eine dichteste Kugelpackung in einer Ebene zeigt das folgende Bild:
 |
| Bild 4: Dichteste Kugelpackung in einer Ebene |
Bei den Metallgittern gibt es noch einige Unterschiede zu beachten. Das betrifft vor allem die Schichtung der Ebenen.
Stell dir vor, du müsstest eine Handvoll Murmeln ganz dicht aneinander reihen und aufschichten. Es bilden sich Muster wie in Bild 4. Die Formen, die du erhältst, entsprechen denen der Kristallstrukturen von Metallen. Die Kugel oder Murmeln in Bild 4 sollen Atome symbolisieren. Es entstehen so genannte Kugelpackungen, die entweder eine kubisch-dichteste, hexagonal-dichteste oder kubisch-raumzentrierte Form haben.
Die Verformbarkeit von Metallen
Das Schichtenmodell macht die Verformbarkeit der Metalle verständlich: Bei der
Verformung gleiten die Schichten der Metallatome aneinander vorbei und nehmen danach neue
Plätze ein, wobei aber insgesamt das Metallgitter erhalten bleibt (-> Bild 4).
In der Technik muss das Metallstück dazu im Allgemeinen erhitzt werden, wie du es
vom Eisenschmied her kennst ("Warmverformen").
Einige weichere Metalle, also solche mit besonders gleitfähigen Gitterschichten,
kann man schon bei Zimmertemperatur schmieden. Vielleicht hast du im Urlaub schon einmal einem
Kupferschmied zugesehen, der aus einem flachen Kupferblech Gefäße mit wundervollen
Ornamenten heraushämmert ("Kaltschmieden").
Auch hierzu gibt es einen Versuch: Du kannst Kupferpulver schon durch den Druck eines
Spatels zu einem Metallstück vereinigen (-> Versuch).
Legierungen und molekularer Schmirgelsand
Nun lässt sich auch erklären, warum Mischungen von verschiedenen Metallen
(Legierungen) so hart sein können. Schmilzt man z. B. 80 Teile weiches Kupfer und 20 Teile weiches Zinn
zusammen, erhält man die harte Bronze. Diese ist wesentlich härter als Kupfer. Der Grund:
Beim Erstarren der Legierung lagern sich in die Schichten aus kleinen Kupferatomen (Durchmesser
1,28 Angström) große Zinnatome (1,55 Angström) ein und verhindern so, dass
die Gitterschichten beim Verformen leicht aneinander vorbeigleiten können. Die Zinnatome
wirken also wie atomarer "Schmirgelsand". Dieser Begriff stammt aus einem lesenswerten Buch von Jakob Bronowski [1].

Bild 5: Bronzebeile
(Foto: Blume)
Einkristallgitter sind besonders stabil
Für Turbinenschaufeln benötigt man besonders stabile Metalle bzw. Legierungen.

Bild 6: Mehrstufige Flugzeug-Turbine
(Foto: Blume)
Denn sie müssen extrem hohen Belastungen wie Hitze und Fliehkräften aufgrund der hohen
Drehzahlen widerstehen. Hätten sie wie üblich gegossene Metalle ein
Kristallgefüge, so würden sie an den Kristallgrenzen auseinanderreißen. Nun kann
man diese Kristallgrenzen "wegschmieden". Das ist aber nur in begrenztem Umfang möglich.
Besser ist es, die Turbinenschaufeln besonders hochbelasteter Turbinen wie etwa von
Düsenjets aus einem einzigen Kristall zu züchten oder zu fräsen. Dann wird die
Stabilität der Metallbindung besonders deutlich. Technisch macht man das, indem man
Metallpulver bei hohen Temperaturen und hohem Druck sintert ("Pulvermetallurgie").
Im Modellversuch kann man auch feinstes ("amorphes", d. h. gestaltfreies, formloses)
Metallpulver durch kräftiges Pressen zu einem größeren Metallstück
umformen (-> Versuch).
Wie man Einkristalle herstellt, lernst du genauer auf einer besonderen Webseite. Auch in biologischen Systemen werden die Eigenschaften von Einkristallen geschätzt. Deshalb entstehen sie bei der Biomineralisation.
Literatur
[1] Jacob Bronowski: Der Aufstieg des Menschen. Ullstein-Verlag, Frankfurt/Main, 1976.
Weitere Texte zum Thema „Kristalle“