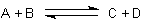
Die kinetische Herleitung des Massenwirkungsgesetzes
Zum Massenwirkungsgesetz gibt es zwei Zugangsmöglichkeiten, einen dynamischen und einen statischen Weg.
Der erste Weg ist der reaktionskinetische Ansatz, bei dem man die
Geschwindigkeiten der Hin- und der Rückreaktion vergleicht. Hierbei stehen die
dynamischen Aspekte im Vordergrund. Die kinetische Herleitung des
Massenwirkungsgesetzes beruht auf Guldberg und Waage (1867).
Die Gleichgewichtsreaktion ist
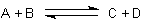
Sie definierten zwei Reaktionsgeschwindigkeiten:
1 Hinreaktion mit der Geschwindigkeitskonstanten khin
vhin = - khin · CA · CB
2 Rückreaktion mit der Geschwindigkeitskonstanten krück
vrück = - krück · CC · CD
Im Gleichgewicht sind beide Reaktionsgeschwindigkeiten gleich.
khin · CA · CB = krück · CC · CD
Daraus folgt
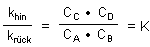
Damit wird deutlich, dass die Gleichgewichtskonstante nicht nur mit Konzentrationen
definiert wird, sondern auch durch kinetische Konstanten. Damit wird ein wichtiger Aspekt des
praktischen Ablaufs chemischer Gleichgewichtsreaktionen deutlich:
Chemische Reaktionen benötigen (manchmal viel) Zeit zur Einstellung ihres
Gleichgewichtszustands.
Die Bedeutung dieser Ableitung liegt weiterhin auch darin, dass sie geholfen hat, das Bild von den
dynamischen Vorgängen im chemischen Gleichgewicht zu verfestigen.
Diese Definition der Gleichgewichtskonstanten begegnet uns auch in der Biochemie
wieder, in der Michaeliskonstanten von Enzymen.
Beim anderen, dem thermodynamischen Weg zur Herleitung des Massenwirkungsgesetzes betrachtet man die Eigenschaften von Zuständen. Man vergleicht dabei nur die Energien und geht deshalb eher statisch vor. Diese Betrachtungsweise bringt die Freie Energie ins Spiel. Sie ermöglicht zudem auch Aussagen über die Steuerbarkeit von chemischen Gleichgewichten, die wir am Beispiel des Hochofenprozesses erläutern.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“