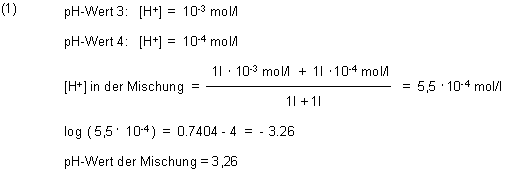
Der pH-Wert des Gemischs starker Säuren
Es geht um folgende Aufgabe: Der pH-Wert einer Mischung zweier Salzsäurelösungen (je ein Liter mit pH = 3 bzw. pH = 4) soll berechnet werden, ebenso die Hydroxid-Ionen-Konzentrationen aller drei Lösungen.
Das Problem ist offenbar Folgendes: Berechnet man mit den üblichen Rechenvorschriften für Mischungen die Konzentrationen von Oxonium-Ionen sowie von Hydroxid-Ionen, so findet man
[H+] = 5,5 · 10-4 mol/l
[OH-] = 5,5 · 10-11 mol/l
Als Ionenprodukt des Wassers erhält man dann aber 3,025 · 10-14 (mol/l)2 und nicht, wie normalerweise zu erwarten, 10-14 (mol/l)2.
(Klicke die Frage 2055 an.)
Was also ist bei der Berechnung der Mischungskonzentrationen zu beachten?
Der pH-Wert der Säuremischung
Man geht von den Säurekonzentrationen (abgekürzt als [H+]) der vorgelegten Lösungen aus.
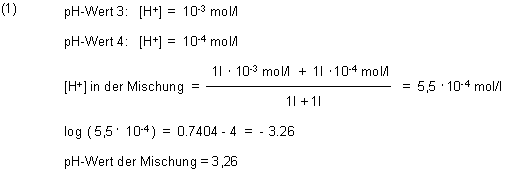
Zu den Konzentrationen der Hydroxid-Ionen
Zunächst berechnet man die Konzentrationswerte [OH-] der zu mischenden Säurelösungen. Das erfolgt mit Hilfe des
Ionenprodukts des Wassers Kw.
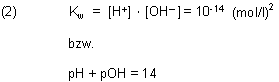
Man setzt die Werte für [H+] ein.
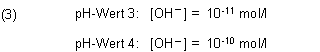
Wenn man die Lösungen mischt, verändern sich nicht nur die Konzentrationswerte der Oxonium-Ionen, sondern auch die zugehörigen Konzentrationswerte der Hydroxid-Ionen.
Nun darf man eine zu Gleichung (1) analoge Mischungsrechnung nicht auch noch für die Hydroxid-Ionen durchführen. Beachtet man das nicht, so würde das zu [OH-] = 5,5 • 10-11 mol/l führen und folglich auch zu dem oben angeführten falschen Wert für das Ionenprodukt des Wassers:
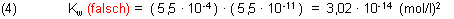
Vielmehr ist die Mischungsrechnung nur für eine Spezies zulässig, weil das Ionenprodukt des Wassers (2) als einschränkende Randbedingung zu beachten ist. Als Basis für die Berechnung dient unterhalb pH-Wert 7 die Säure-Konzentrationen, über pH-Wert 7 die Konzentration der Base bzw. Lauge. Der Grund für nur eine Basis ist auch, dass sich bei pH-Wert 7 die zwei Gleichgewichte des Wassersystems überlagern, nämlich H3O+/H2O mit pK1 = -1,743 sowie H2O/OH- mit pK2 = 15,743. Unterhalb pH 7 ist das Säuresystem dominant, oberhalb pH 7 das Laugesystem.
Das Ionenprodukt des Wassers ist formal eine Hyperbel vom Typ y = a/x.
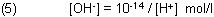
Die Konzentrationen [H+] und [OH-] sind also umgekehrt zueinander proportional. Anders gesagt: Die Hydroxid-Ionen-Konzentration ändert sich in dem umgekehrten Maße, wie sich die Oxonium-Konzentration ändert.
Um das zu prüfen, setzt man in (5) den eben berechneten Mischungswert von [H+] ein:
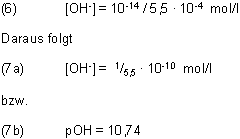
Aufgrund des Rechengangs muss man natürlich den richtigen Wert für das Ionenprodukt des Wassers erhalten; vergleiche (2).
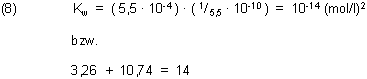
Eine Ursache für die Verständnis-Probleme liegt nicht nur im schwierigen Umgang mit umgekehrten Proportionalitäten, sondern auch in der Unübersichtlichkeit der logarithmischen Stauchung von Titrationskurven.
Zum Schluss sei darauf hingewiesen, dass es sich bei den „Konzentrationen“ um Aktivitäten handelt. Das erschwert etwas die experimentelle Überprüfung der berechneten pH-Werte. Denn man darf deshalb nicht exakt die pH-Werte erwarten, die man ohne Berücksichtigung von Aktivitäten-Korrekturen ermittelt hat.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“