
Der pH-Wert des Gemischs zweier schwacher Säuren
Experimente:
Versuch: Der pH-Wert des Gemischs zweier schwacher Säuren
Versuch: Reagiert Glycin sauer? (Isoelektrischer Punkt)
Wenn wir starke Säuren mischen, ist die Konzentration der Protonen in der Mischung gleich
der Summe der Konzentrationen der Säuren (wobei wir noch die Verdünnung berücksichtigen bzw. auf einen
Liter umrechnen müssen). Denn starke Säuren sind vollständig dissoziiert.
Wenn zwei verschiedene schwache Säuren in einer wässrigen Lösung vorliegen, darf man die Konzentrationen der Protonen bzw. der Hydronium-Ionen, die von den Säuren freigesetzt werden, nicht einfach addieren. Ihrer Konzentrationen müssen gewichtet werden. Dabei spielen die Gleichgewichtskonstanten eine wichtige Rolle.
Fangen wir bei einer einzelnen Säure an. Die Konzentration der Protonen einer schwachen Säure in Lösung bzw. der daraus resultierende pH-Wert der Lösung werden durch folgende Beziehungen gegeben.

(Wie man zu dieser Beziehung gelangt, rechnen wir hier vor.)
Rechenbeispiele
1 Essigsäure (c = 0,1 mol/l) (pK = 4,75); -> pH-Wert 2,88
2 Chloressigsäure (c = 0,1 mol/l) (pK = 2,87); -> pH-Wert 1,94
Wenn zwei Säuren nebeneinander vorliegen, müssen wir den Beitrag einer jeden Säure zur Erhöhung der
Protonenkonzentration ermitteln und dann addieren. Wohl gemerkt: Wir dürfen nicht die nach obiger
Gleichung ermittelten pH-Werte addieren!
Die Dissoziationskonstanten dienen als Gewichtungsfaktoren den dadurch definierten Dissoziationsgrad für den Protoneneintrag der jeweiligen Säure.
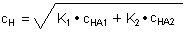
Rechenbeispiel
Wir mischen Essigsäure (c = 0,2 mol/l) (pK = 4,75) und Chloressigsäure (c = 0,2 mol/l) (pK = 2,87) im
Volumenverhältnis 1:1 (-> Versuch). Dann sind die Konzentrationen in der Lösung jeweils
c = 0,1 mol/l.
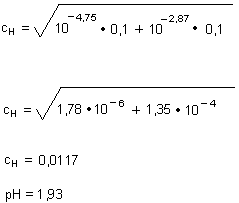
Erstaunlicherweise wirkt sich die Essigsäure kaum aus. Das liegt daran, dass sie in dem stärker sauren
Milieu der Chloressigsäure fast gar nicht dissoziiert ist.
Man kann mit der Beziehung natürlich auch Mischungen, die aus mehr als zwei Säuren bestehen, berechnen.
Einbeziehung von Basen
Mit diesem gedanklichen Ansatz lässt sich auch berechnen, wie sich Mischungen von zwei Basen oder von Säure
und Base verhalten. Dazu bedient man sich der Gleichungen in der oben angeführten Webseite.
Wenn die Konzentrationen von Base und Säure gleich sind, erhalten wir folgende einfache Beziehung:
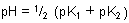
Diese Gleichung sollte allgemein bekannt sein. Es handelt sich nämlich um die Gleichung zur Berechnung des
so genannten Isoelektrischen Punkts von Aminosäuren.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“