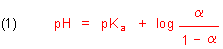
Säure/Base-Gleichgewichtskurven: Kurvendiskussion zur Henderson-Hasselbalch-Gleichung
Die grundlegende Funktion von Säure/Base-Gleichgewichten ist die Henderson-Hasselbalch-Gleichung. Hier ist ihre einfachste Form:
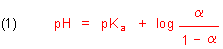
Das Symbol a steht für den Dissoziationsgrad.
Diese Gleichung beschreibt einen Teil der Titrationskurven von Säure/Base-Systemen. Zum Verständnis von Titrationskurven ist es deshalb gut, wenn man sich die mathematische Funktion genauer ansieht. Dazu ist eine Kurvendiskussion hilfreich. Das ist von Vorteil auch für den Mathematikunterricht, der ja oft genug darunter leidet, dass es an praktischen Beispielen fehlt.
Im Folgenden wird die Kurvendiskussion für Gleichung (1) gezeigt. Mathematiklehrer mögen verzeihen, wenn die Terminologie und die Abfolge nicht derjenigen entspricht, die bei ihnen gerade „en vogue“ ist.
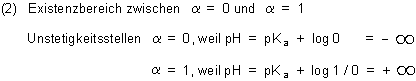
Fazit: Eine solche Kurve muss einfach einen Wendepunkt haben.
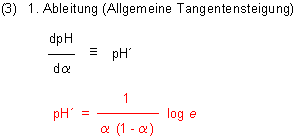
Im Folgenden bestimmen wir die Lage des Wendepunkts.

Die Gleichungen (3) und (4) sind letztlich Parabelfunktionen. Wenn man die Henderson-Hasselbalch-Gleichung (1) sowie ihre erste Ableitung (3) und zweite Ableitung (4) in ein Diagramm zeichnet, wird einem der Zusammenhang klar. So lässt sich auch verstehen, warum die zweite Ableitung unter a = 0,5 negativ ist.
Hier ist erst einmal eine grobe Skizze:

Hinweis:
Die Henderson-Hasselbalch-Gleichung ist ein mathematisches Modell, das nur begrenzt die realen Abläufe bei einer
Titration aufzeigt. Denn es fehlen die Auswirkungen der Zugabe des Titriermittels auf die Gleichgewichtskurve. Das folgende
Bild zeigt reale Titrationskurven.
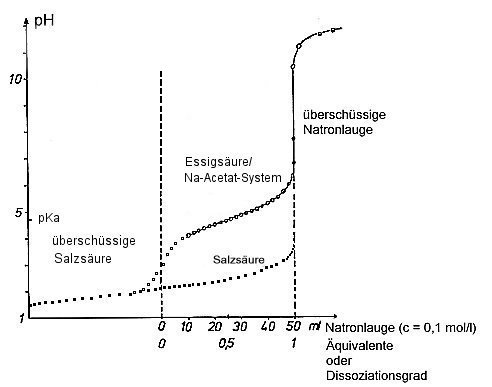
Titrationskurven einer starken und einer schwachen Säure.
Bedingungen siehe Versuch
Unterhalb von pH = pKa – 3 und oberhalb von pH = pKa + 3 wird die Kurve der Henderson-Hasselbalch-Gleichung
von den entsprechenden Kurven des Wassersystems H3O+ / H2O (betrifft überschüssige
Fremdsäuren wie z. B. HCl) sowie H2O / OH- (betrifft überschüssige Fremdbasen/Laugen wie z. B.
NaOH) überlagert.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“