Pufferung
Experimente
Versuch: Pufferwirkung von schwachen Säure/Base-Systemen
Versuch: Abhängigkeit der Pufferwirkung von der Konzentration des
Säure/Base-Systems
Versuch: Ermittlung der Pufferkapazität in Abhängigkeit von der
Konzentration des zugesetzten Elektrolyten
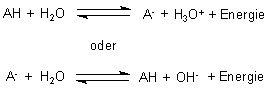
Ein Säure/Base-Gleichgewicht ist erstaunlich unempfindlich gegen pH-Wert-Änderungen.

Das gilt ganz besonders für Mischungen von Säuren und ihren korrespondierenden
Basen.
Gibt man z. B. zu einer Mischung von Essigsäure und Acetat eine starke Säure (HCl),
so verschiebt sich das o. a. Gleichgewicht nach links. Gibt man eine Lauge (NaOH)
zu, so verschiebt sich das Gleichgewicht nach rechts.
Das erkennt man beim Betrachten von Titrationskurven. Die Kurve der Salzsäure
steigt im mittleren pH-Bereich stark an; die der schwachen Säure-Base-Systeme
kaum. Beim Wendepunkt WP2 ist die pH-Wertänderung am geringsten. Hier ist die
Konzentration von Säure gleich der ihrer korrespondierenden Base: pH = pKs. Dies ist
der Punkt der besten Pufferung.
Es gibt für jeden pH-Bereich Puffersysteme (-> Versuch).
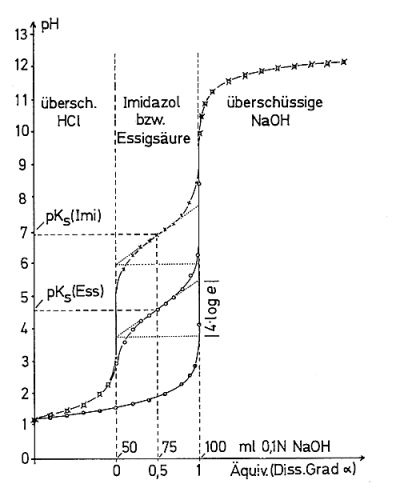
Bild 1: Titrationskurven von Salzsäure, Essigsäure und Imidazol. Bedingungen siehe Versuch
Das Bild zeigt neben der Titrationskurve der starken, also nichtpuffernden Salzsäure zwei
Titrationskurven von schwachen Säure/Base-Systemen. Das ist einmal das Puffersystem Essigsäure/Acetat.
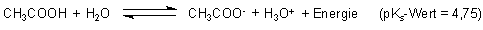
Die andere Kurve betrifft die Base Imidazol bzw. ihre korrespondierende Säure, das Imidazolium-Kation. Da wir durch Zugabe von Salzsäure die Base vor Aufnahme der Titrationskurve in ihre korrespondierende Säure überführen, schreiben wir das Gleichgewicht hier analog wie bei der Essigsäure.
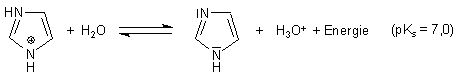
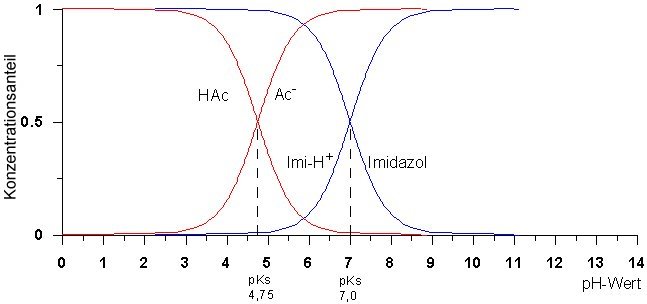
(Erstellt: Wolfgang B.)
Dissoziationsdiagramm von Essigsäure und Imidazolium-Kation
Die Steigung a der Wendetangente an die Titrationskurve in pH = pKs ist
a = pH-Wertänderung / ml Natronlauge
Je konzentrierter das Puffersystem ist, desto schwächer ist die Steigung, desto höher ist die Pufferwirkung. Das zeigt das folgende Bild.
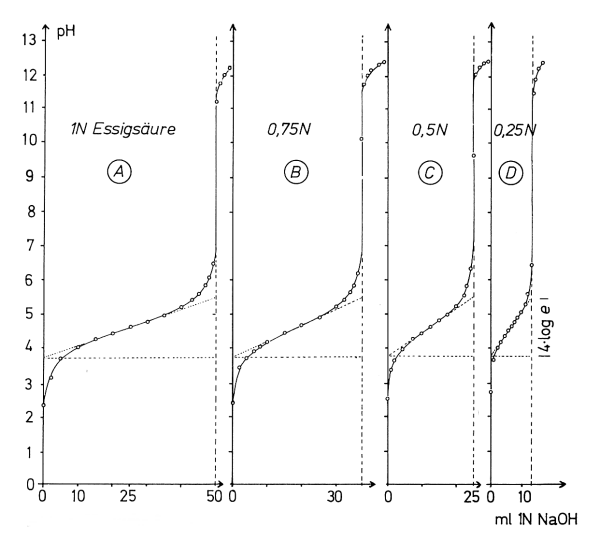
Bild 2: Titrationskurven von Essigsäure verschiedener Konzentrationen mit Natronlauge (c = 1 mol/l). Bedingungen siehe Versuch
Deshalb bezeichnet man den Kehrwert der Steigung als
Pufferkapazität b. Sie ist proportional zur Konzentration des puffernden schwachen
Säure/Base-Systems.
b = ml Titriermittel / pH-Einheit
Sie ist proportional zur Konzentration des puffernden schwachen Säure/Base-Systems. Das folgende Bild zeigt die Pufferkapazität in Abhängigkeit von der Konzentration der zugegebenen Störlösung (hier Natronlauge). Man kann annehmen, dass die Natronlaugekonzentration konstant war und die des vorgelegten Puffersystems variiert wurde.
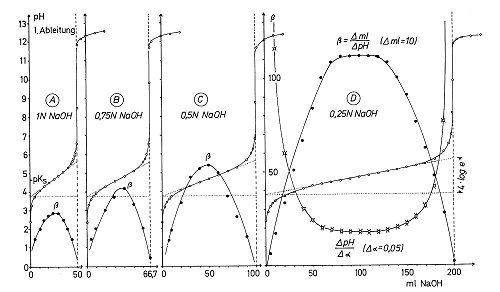
Bild 3: Titrationskurven von Essigsäure (c = 1 mol/l) mit Natronlaugelösungen verschiedener Konzentrationen zur Demonstration der Konzentrationsabhängigkeit der Pufferkapazität. Bedingungen siehe Versuch
Der Wert der Pufferkapazität b hat auch praktische Bedeutung. Die
bezieht sich vor allem auf die Hälfte seines Werts, also b/2,
links und rechts vom Wendepunkt:
| - | Er ist einmal die ml-Zahl an Titriermittel, bei dem sich der pH-Wert um eine Einheit ändert. Man kann auch sagen, dass sich oberhalb und unterhalb vom pKs-Wert der pH-Wert je um eine halbe Einheit ändert. |
| - | Er ist außerdem die ml-Zahl an Titriermittel, bei dem die Wendetangente in etwa mit der Titrationskurve verläuft. Solche linearen Bereiche kann man gut steuern und außerdem zur Fehlerabschätzung bei schlecht gepufferten Systemen nutzen. |
Puffer, die den pH-Wert bei kinetischen Untersuchungen (etwa bei enzymatischen Hydrolyse-Reaktionen) konstant halten sollen, müssen nach einer Faustregel 1000fach konzentrierter sein als die Störsubstanz (H+ oder OH-).
Puffersysteme spielen eine wichtige Rolle bei der Konstanthaltung des pH-Wertes von Körperflüssigkeiten. Hier wirkt vor allem der Bicarbonat-Puffer aus dem System
CO2-Wasser / Kohlensäure / Bicarbonat / Carbonat.
Auch bei der Regulation des Boden-pH-Werts wirken Puffersubstanzen wie vor allem die Silicate mit. Hierauf gehen wir in weiteren Webseiten ein.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“