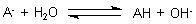
Die Säure/Base-Titrationskurve von Essigsäure und die Henderson-Hasselbalch-Gleichung
Experimente:
Versuch: Vergleich der Titrationskurven von Essigsäure und Salzsäure
Versuch: Simulation einer Titrationskurve durch Mischung von
Salz- und Säurelösung
Die Titration einer schwachen Säure AH mit Natronlauge (-> Versuch)
verläuft nach der umgekehrten Hydrolyse-Gleichung von Acetat:
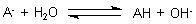
Man verschiebt durch Zugabe von OH--Ionen das Gleichgewicht nach links.
AH + OH- ———> A- + H20
Zur Auswertung der Titration trägt man den nach jeder Zugabe gemessenen pH-Wert gegen die ml-Zahl an zugegebener Natronlauge auf und erhält Titrationskurven wie in Bild 1. Zum Vergleich titriert man auch die gleiche Menge an starker Säure (hier Salzsäure). Hinzu kommen noch Titrationen von Mischungen von Essigsäure und Salzsäure mit Natronlauge sowie von Natriumacetat mit Salzsäure (-> Versuch).
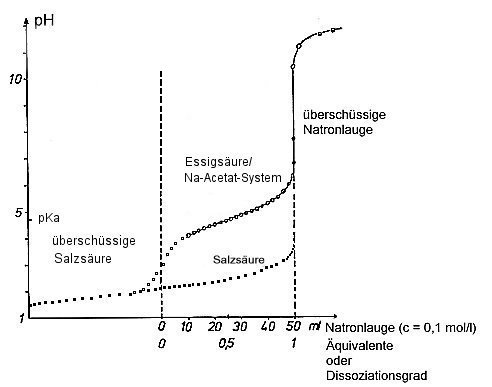
Bild 1: Titrationskurven einer starken und einer schwachen Säure.
Bedingungen siehe Versuch
Man erhält zwei Kurven, die unterschiedlich verlaufen:
Starke Säure
Man erkennt, dass die Kurve bei einem pH-Wert bei etwa 2 startet. Sie weist nur einen
Wendepunkt auf, nämlich den mit senkrechter Wendetangente beim Äquivalenzpunkt. Der ist zugleich
der Neutralpunkt (pH-Wert 7).
Schwache Säure
Die Titrationskurve startet bei pH 3. Das liegt daran, dass die Säure nur etwa zu einem
Tausendstel dissoziiert ist. Die steigt zu Beginn stärker an, um dann in einen Wendepunkt mit
flacher Wendetangente einzumünden. Hier wird die undissoziierte Säure unter Zusatz von
OH--Ionen zerlegt. Dadurch verändert sich der pH-Wert nur wenig. Dieser
Gleichgewichtszustand wird durch diesen Wendepunkt, nämlich dem bei pH = pKs, charakterisiert,
der bei der starken Säure nicht in Erscheinung tritt. Denn die ist ja von vornherein vollständig
dissoziiert. Dann läuft die Kurve in den Wendepunkt mit steiler Wendetangente beim Äquivalenzpunkt,
der hier aber nicht der Neutralpunkt ist. Das liegt daran, dass das Gleichgewicht bei pH 7 noch
nicht vollständig auf der Seite der Anionen liegt und man einen höheren Druck an OH--Ionen
benötigt, um die gesamte Säure zu zerlegen.
Es schließt für beide Säuretypen der Kurventeil der überschüssigen OH--Ionen an.
Der Algorithmus der Gleichgewichtstitration des Essigsäuresystems ist die bekannte Puffergleichung (Henderson-Hasselbalchsche Gleichung).
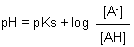
Man kann statt der Konzentrationen auch den Dissoziationsgrad a einführen. Mit a = [A-] / Co und (1 - a) = [AH] / Co folgt:
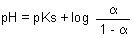
(Co ist die Gesamtkonzentration an Säure plus Salz.)
Die Dissoziationsgrad-Achse lässt sich auch als Äquivalenz-Achse auffassen. Sie verläuft ebenfalls von 0 bis 1. Der Wendepunkt liegt bei pH = pKs. Hier gilt a = 1 - a = 0,5; die Halbäquivalenz ist erreicht.
Der Dissoziationsgrad a bzw. (1 - a) kann auch durch die Volumenteile (Volumen in ml) ersetzt werden. Das ist so, als wenn man gleichkonzentrierte Lösungen von Säure und ihrem Salz mischt (-> Versuch).
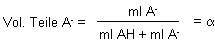
sowie
Vol.Teile AH = 1 - Vol.Teile A- = 1 - a
Man sollte nach dieser Gleichung eine Titrationskurve simulieren können, indem man Essigsäure- und Natriumacetat-Lösungen in verschiedenen Mengenverhältnissen zusammengibt und jeweils den pH-Wert misst (-> Versuch und Bild 2).
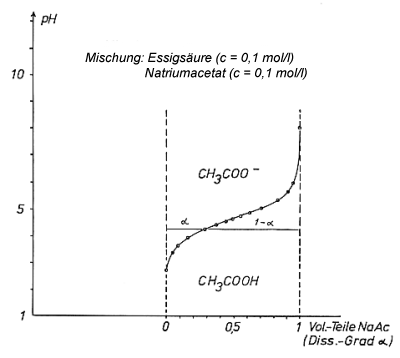
Bild 2: Durch Mischung von Salz- und Säurelösung nach Versuch erhaltene Kurve
Die Kurve in dem Bild 2 wird über die Kurve des Bildes 1 gelegt. Die Kurven decken sich
im Bereich um pH 4,7. Folglich ist auch die Titrationskurve eine Gleichgewichtskurve.
Auf den Parallelen zur a-Achse durch einen Punkt der Kurve von Bild 2 kann man den Konzentrationsanteil von A- bzw. AH und damit auch den Dissoziationsgrad direkt ablesen. Die Fläche oberhalb der Kurve ist die Zustandsfläche der Acetat-Ionen, die Fläche unterhalb der Kurve ist die der undissoziierten Essigsäure. Beide korrespondierenden Säure-Base-Formen stehen also längs der Kurve im Gleichgewicht. Die so durch das Mischungsverfahren erhaltene Kurve ist also eine echte Gleichgewichtskurve.
Oftmals findet man auch die Darstellung a (bzw. 1 - a) gegen den pH-Wert. Dieses ist das so genannte Dissoziationsdiagramm und beschreibt die Konzentration von Anion (bzw. Säure) bei bestimmten pH-Werten (-> Bild 3).
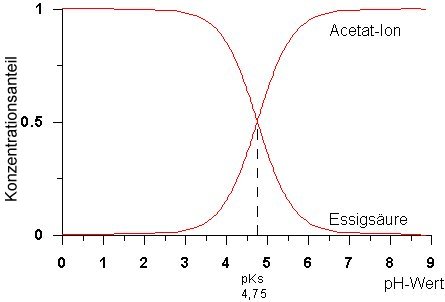
(Erstellt: Wolfgang B.)
Bild 3: Dissoziationsdiagramm der Essigsäure
Wenn Ihre mathematischen Fähigkeiten ausreichen, führen Sie eine Kurvendiskussion
des Algorithmus der Titrationskurve einer schwachen Säure pH = f(a), der
Puffergleichung, durch. Die dabei erhaltene Kurve ist identisch mit der aus dem Versuch.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“