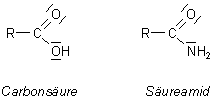
Amide - Die reaktionsträgsten Säure-Derivate
Säureamide sind Derivate von Sauerstoffsäuren, bei denen die Hydroxylgruppe durch eine Aminogruppe ersetzt ist. Die bekanntesten Säureamide sind die der Carbonsäuren; sie sind die Säureamide schlechthin.
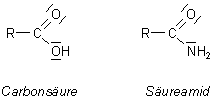
Die H-Atome in der Säureamidgruppe können durch organische Reste substituiert werden.
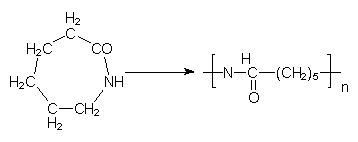
Hinzu kommen noch cyclische Säureamide. Das sind die Lactame. Ein Beispiel ist das e-Caprolactam, aus dem Perlon hergestellt wird.
Säureamide werden hergestellt, indem man das entsprechende Säurechlorid mit Ammoniak oder einem Amin umsetzt.
R-COCl + NH3 ———> R-CONH2 + HCl
Warum sind Säureamide so reaktionsträge?
Säureamide sind anders als die Ester stärker durch Mesomerie stabilisiert. Das liegt daran, dass
der Stickstoff weniger elektronegativ ist als Sauerstoff und somit eher sein Elektronenpaar
an das mesomere System abgibt.
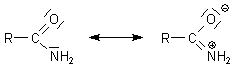
Diese Stabilisierung hat Folgen für die Reaktivität der Säureamide.
Sie reagieren in wässriger Lösung nicht basisch, sondern neutral. Denn sie verhalten sich
aufgrund des fehlenden freien Elektronenpaars am N-Atom nur als äußerst schwache Basen, die nur
am Sauerstoff protoniert werden können.
Experimentell lässt sich die Reaktionsträgheit der Amine auch bei ihrer Hydrolyse beobachten.
Denn die Hydrolyse von Säureamiden erfordert extreme Bedingungen: Z. B. konzentrierte Salzsäure
oder Lauge, Temperaturen über 100 °C, die man nur in einem Bombenrohr erreicht, und ein bis
zwei Tage Kochzeit... Das liegt daran, dass (anders als bei Estern!) das zentrale C-Atom nicht
positiv polarisiert ist. Deshalb ist der nucleophile Angriff eines Wassermoleküls oder eines
Hydroxid-Ions erschwert. Auch die Protonen wirken sich hier kaum als Katalysatoren aus, weil
das Sauerstoffatom des Säureamids nur schwer zu protonieren ist.
Säureamide sind technisch wichtig
Unter ihnen befinden sich die wichtigsten High-Tech-Kunststoffe wie Nylon
und Perlon, Kevlar oder Aramid. Sie sind Polyamide.
Aber auch Polyurethane gehören hierzu. Sie sind gleichzeitig
Polyamide und Polyester.
Übrigens gibt es unter den niedermolekularen Säureamiden wichtige Lösemittel. Bekannt ist besonders Formamid, mit dem man zum Beispiel Zucker lösen kann. Das ist wichtig, wenn es auf wasserfreies Milieu ankommt - wie z. B. bei den Polyurethansynthesen.
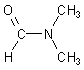
Säureamide sind in der Biochemie wichtig
Aminosäuren verbinden sich zu Proteinen. Sie sind
biogene Polyamide. Die Bindung beruht auf der Bildung von substituierten Säureamiden. Wir sprechen von
einer Peptidbindung.
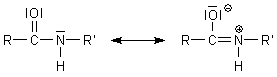
Diese Bindung ist mesomeriestabilisiert und deshalb besonders stabil, so dass die klassisch-chemische
Hydrolyse nur unter den Bedingungen abläuft, die oben geschildert wurden. Glücklicherweise liegt das nur
an der hohen Aktivierungsenergie. Denn die Bindung selbst befindet sich chemisch auf hohem Potential -
das zeigt schon der Energieaufwand, der zur Proteinbiosynthese betrieben wird.
Die Aktivierungsenergie wird durch Enzyme gesenkt. Das funktioniert durch spezielle aktive Zentren,
die vor allem die Energiesenke des mesomeren Zustands überwinden helfen. Die Proteasen sind deshalb
effektive Verdauungshilfen. Außerdem werden auch in modernen Labors die Proteinmoleküle nur noch
enzymatisch gespalten. Denn bei den klassischen, energischen Abbaumethoden werden viele Aminosäuren
durch Nebenreaktionen "unkenntlich" gemacht.
Diese Mesomerie hat aber auch zur Folge, dass die Peptidbindung nicht mehr frei drehbar ist. Man beobachtet deshalb Stereoisomerie. Außerdem ist das N-Atom so gering basisch geworden, dass das H-Atom zu benachbarten Gruppen (vor allem zur benachbarten polarisierten Carbonyl-Gruppe) eine stabilisierende Wasserstoffbrücke aufbauen kann. Das ist die Grundlage der Sekundärstruktur von Proteinen, bekannt als Helix oder Faltblatt.
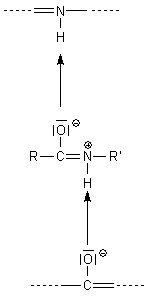
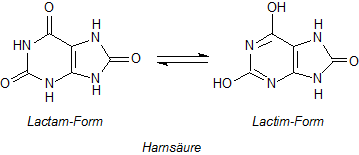
Beispiele für Lactame finden wir in der Chemie der Purinbasen. Sie zeigen eine der Keto/Enol-Tautomerie analoge Isomerie, die Lactim/Lactam-Tautomerie. Die entstehende Hydroxylgruppe reagiert wegen der benachbarten Doppelbindung sauer. Das betrifft ganz besonders die Harnsäure. Sie bildet zwei Reihen von Salzen.
Der Spezialfall Kohlensäure
Wenn man die Kohlensäure H2CO3 entsprechend schreibt, kann man sie auch als
Hydroxyameisensäure auffassen: HO-COOH. Das Amid der Kohlensäure heißt Carbamidsäure (auch Carbaminsäure
genannt); sie ist im Gegensatz zu ihren Salzen instabil. Ihre Derivate sind der Harnstoff (Kohlensäurediamid)
und Ester (Urethane).
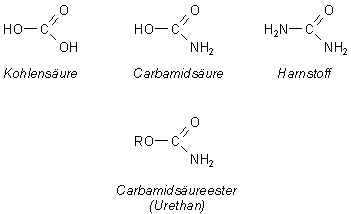
Die Carbamidsäure spielt eine wichtige Rolle bei der enzymatischen Hydrolyse von Harnstoff. Sie ist das eigentliche Produkt der Urease-Reaktion, das allerdings rasch zu Ammoniak und Kohlenstoffdioxid zerfällt.
Spezialfall Sulfonamide
Weitere, pharmazeutisch äußerst interessante Amide sind die der Sulfonsäuren, die Sulfonamide.
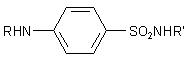
Allgemeine Formel der Sulfonamide
Eine erste Sulfonamid-Synthese wurde bereits 1908 durchgeführt. Sie dient der Suche nach neuen Farbstoffen. Erst 1932 wurde die antibakterielle Wirkung der Stoffgruppe erkannt. Grund: Es war bekannt, dass man mit speziellen Farbstoffen Bakterien anfärben kann. Da kam rasch die geniale Idee auf, dass - wenn die Bakterien selektiv Farbstoffe absorbieren - sie auch gezielt Wirkstoffe aufnehmen können müssten, die sie schädigen.
Ihre antibakterielle Wirkung verdanken die Sulfonamide ihrer sterischen Ähnlichkeit mit einem wichtigen Wachstumsfaktor vieler Bakterien, der p-Aminobenzoesäure.
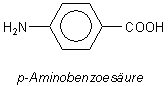
Diese ist notwendig zum Aufbau von Folsäure. Die Sulfonamide wirken als Hemmstoffe der Synthese. Mit ihrer Hilfe lassen sich Krankheiten wie Lepra, Malaria oder andere bakterielle Erkrankungen bekämpfen.
Zusammen mit einem speziellen Lactam, dem Penicillin, haben die Sulfonamide vielen Menschen geholfen, ihr Leben zu verlängern.
Es gibt auch cyclische Sulfonamide, die Sulfame. Sie spielen eine wichtige Rolle als Süßstoffe. Bekannte Beispiele sind Saccharin(-Na) und Acesulfam(-K).
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“