Zur Struktur der Nichtmetall-Hydride: Der Hydridverschiebungssatz
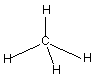
Die Nichtmetalle der zweiten Reihe des PSE bilden Hydride. Wie sind ihre Moleküle aufgebaut, was ist ihre Struktur? Sie beruhen letztlich alle auf einem Tetraeder.

Die Moleküle des Methans sind völlig symmetrisch und daher unpolar.
Nun betrachten wir die Hydride von Stickstoff NH3 und von Sauerstoff H2O. Die Strukturen der Moleküle von Ammoniak und Wasser stellen Ausschnitte aus dem Methantetraeder dar.
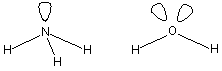
Die nichtbindenden Elektronenpaare weisen ebenfalls in die Tetraederecken. Sie sorgen für die Polarität der Moleküle von Wasser (stark polar) und Ammoniak (weniger polar).
Gilt das auch für Oxonium- und für Ammonium-Ionen?
Wasser bildet mit Protonen Oxonium-Ionen H3O+. Auch deren Struktur
entspricht einem Ausschnitt aus dem Tetraeder. Ihre Struktur gleicht völlig dem des Ammoniakmoleküls.
Ammoniak bildet mit Protonen Ammonium-Ionen NH4+. Das Ion entspricht
strukturell dem Methanmolekül; es ist wie ein vollständiger Tetraeder aufgebaut.
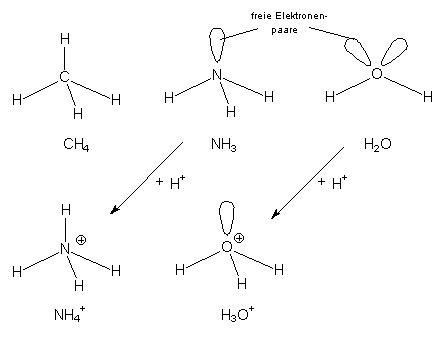
Die Moleküle CH4, NH3, H2O, NH4+ und H3O+ im Vergleich
Was steckt hinter dem Hydridverschiebungssatz?
Um zu verstehen, warum die Verbindungen nicht planar und warum die Hydride von C, N und O untereinander
alle so ähnlich aufgebaut sind, müssen wir die Molekülorbitale betrachten. Bei den Hydriden von C, N und O
handelt es sich um Verbindungen, bei denen die Zentralatome durch Vermischung der kugeligen 2s und der drei
hantelförmigen 2p-Orbitale insgesamt vier weit ausladende 2sp3-Hybridorbitale ausbilden.

(Foto: Nerge)
Diese Orbitale stehen weitgespreizt so zueinander, dass sie in die Ecken eines Tetraeders weisen. Das gilt auch für die Orbitale, die statt eines H-Atoms zwei nichtbindende Elektronen aufweisen.
Und wie steht es mit dem Chlor?
Wir könnten natürlich auch noch das Chlorhydrid HCl diskutieren. Das bildet mit Protonen jedoch keine
höheren Verbindungen wie z. B. H2Cl+. Das liegt an der geringen Basizität
des Chlorid-Ions. Anders gesagt: Chlor bildet kaum 2sp3-Hybridorbitale aus. Dafür gibt es
verschiedene Gründe. So enthält der Atomkern von allen bindungsfähigen Elementen aus der zweiten Reihe
des PSE die meisten positiven Kernladungen. Deshalb wird die Hülle an den Kern gezogen, das Chloratom
hat somit auch den geringsten Radius. Die nichtbindenden Chlorid-Orbitale entsprechen eher reinen
2s- und 2p-Orbitalen, stehen also senkrecht aufeinander. Insgesamt ragen seine Orbitale nicht so weit
nach außen, so dass das Andocken von Protonen H+ kaum mehr möglich ist. Hinzu kommt die
abstoßende Wirkung des positiven Chlor-Atomkerns auf das Proton.
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“