Autokatalyse bei Redoxreaktionen mit Kaliumpermanganat
Experimente:
Versuch: Autokatalyse bei der Permanganat Oxalsäure-Oxidation
Bei vielen Reaktionen wird der Katalysator erst während der Reaktion gebildet. Das hat eine Beschleunigung des Ablaufs zur Folge. Man spricht von Autokatalyse.
Hier ein leicht nachzuvollziehendes Beispiel: Oxidiert man Oxalsäure mit Kaliumpermanganat, so sollte sich die Lösung entfärben.
Ox: COOH-COOH ———> 2 CO2 + 2 e- + 2 H+ · 5
Red: MnO4- + 8 H+ + 5 e- ———> Mn2+ + 4 H2O · 2
Redox: 5 COOH-COOH + 2 MnO4- + 6 H+ ———> 10 CO2 + 2 Mn2+ + 8 H2O
Zunächst scheint gar nichts zu geschehen (-> Versuch). Dann beginnt die Reaktion langsam einzusetzen, was man an der beginnenden Entfärbung der Lösung erkennt. Die Entfärbung geht zum Schluss immer schneller vonstatten. Grund ist, dass Mangan(II)-Ionen die Reaktion katalysieren. Da diese sich während der Reaktion bilden, nimmt die Konzentration des Katalysators im Verlaufe der Reaktion zu.

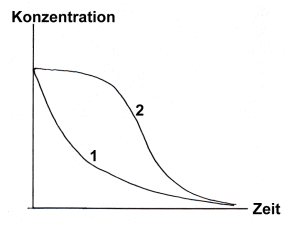
Bild des zeitlichen Ablaufs einer gar nicht oder "normal" katalysierten Reaktion (1) und einer Autokatalysereaktion (2)
Die Rolle der Mangan(II)-Ionen kann man leicht zeigen, indem man sie, wie in unserem Versuch geschehen, zum Vergleich von vornherein zur Reaktionsmischung zugibt. Dann wird der Autokatalysebereich sehr kurz.
Das obige Bild erhält man auf einfache Art und Weise, indem man die Reaktion (-> Versuch) in einer Küvette startet und spektrometrisch bei etwa 560 nm verfolgt.
Weitere Texte zum Thema "Oxalsäure"