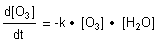
Abbau von Ozon in Wasser
Experimente:
Versuch: Reaktionen von Ozon mit Wasser
Ozon löst sich besser als Sauerstoff in Wasser, da es polarer ist. Allerdings
wird es in Wasser abgebaut.
2 O3 + H2O ———> 2 OH · (oder H2O2) + 2 O2
Die Geschwindigkeit des Abbaus hängt vom pH-Wert ab. In alkalischen Lösungen erfolgt der Abbau wesentlich rascher als in sauren (-> Versuch).
Der Abbau ist eine Reaktion pseudo-erster Ordnung. Dabei setzt sich ein
Stoff in einer bimolekularen Reaktion mit einem Reaktionspartner um, dessen
Konzentration wegen großen Überschusses konstant bleibt (hier Wasser).
Die Differentialgleichung für die Reaktionsgeschwindigkeit der Reaktion zweiter
Ordnung lautet
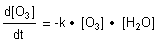
und unter den Bedingungen pseudo-erster Ordnung
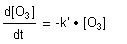
Die Reaktion wird fotometrisch bei 254 nm, dem Absorptionsmaximum von Ozon, verfolgt. Für die Extinktion nach Reaktionsende gilt: E¥254 = 0, weil die Reaktionsprodukte bei dieser Wellenlänge kaum absorbieren. Damit lautet das Konzentrations-Zeit-Gesetz erster Ordnung in der Extinktionsform:
E254 (t) = E0254 exp (-k'· t)
Das folgende Bild zeigt, wie sich das Spektrum des Ozons in Wasser mit der Zeit verändert. Aufgrund des Abbaus von Ozon nimmt die Absorption der UV-Strahlung ab. Der zeitliche Abstand zwischen den einzelnen Spektren beträgt 7 Minuten. Das nächste Bild zeigt das Extinktions-Zeit-Diagramm, das dem Konzentrations-Zeit-Diagramm entspricht.
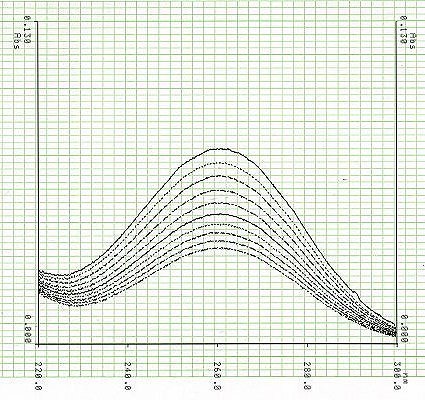
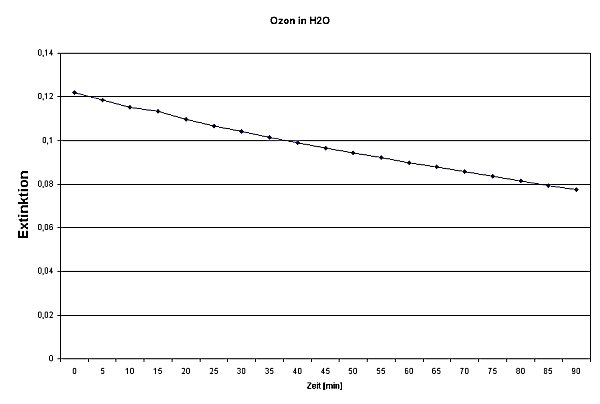
Extinktion254 als Funktion der Zeit für die Reaktion von Ozon mit Wasser.
Die Kurve ist aufgrund der langsamen Reaktion nur schwach gebogen
Zur Überprüfung der Reaktionsordnung und zur Ermittlung der Geschwindigkeitskonstanten pseudo-erster Ordnung k' trägt man ln E gegen die Zeit auf.
ln E254 (t) = ln E0254 - k' · t
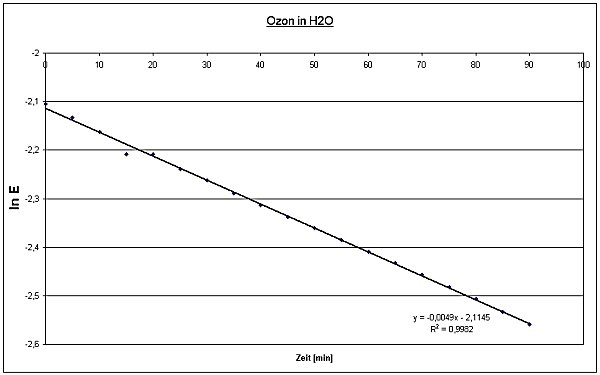
Extinktion E254 als Funktion der Zeit für die Reaktion von Ozon mit Wasser
Aus der Steigung des linearen Bereichs berechnet man k'. Durch Extrapolation
auf t = 0 ermittelt man E0254.
Die Halbwertszeit t½ berechnet man nach der Beziehung
k' · t½ = ln 2
Weitere Texte zum Thema „Ozon“