
Die mesomere Struktur des Ozonmoleküls
Das Ozonmolekül ist gewinkelt aufgebaut. (Früher hat der Autor in der Schule noch gelernt, dass es sich um eine Dreiecksstruktur handeln müsse.)

Wenn man in diesem Molekül zur Konstruktion der Lewis-Formel die 3 X 6 Valenzelektronen der Sauerstoffatome verteilen will, kommt man in Schwierigkeiten. Hier hilft folgende Information: Die Bindungen zwischen den Sauerstoffatomen kann man mit Hilfe von IR-spektroskopischen Untersuchungen ausmessen. Sie sind gegenüber Einfachbindungen etwas verkürzt, haben also partiellen Doppelbindungscharakter. Daher kommt auch die Winkelung des Moleküls zustande: Grund ist die mit der Doppelbindung zusammenhängende Tendenz zur sp2-Hybridisierung der O-Atome. Der partielle Doppelbindungscharakter "riecht" aber auch nach mesomeren Grenzzuständen.
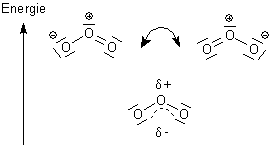
Tatsächlich liegen die Doppelbindungen entweder links oder rechts vom zentralen O-Atom ("lokalisiert"). Diese Zustände ("Grenzzustände") können wir nur beschreiben, indem wir Polarisierungen aufgrund von Ladungstrennungen annehmen. Nun liegen diese Polaritäten nicht fest, sondern die Aufenthaltsorte der Elektronen sind zwischen den Grenzzuständen "zeitlich verschmiert". Die Elektronen sind also nicht in Doppelbindungen fixiert, sondern "delokalisiert". Dieser mesomere Zustand ohne deutliche Ladungstrennung ist energetisch günstiger als die völlige Ladungstrennung.
Man darf nun aber nicht etwa (wie es geschehen ist) aus dem Vorhandensein einer mesomeren Grundstruktur herleiten, dass das Ozonmolekül energiearm und deshalb stabil sei! Bekanntlich ist das Gegenteil der Fall: Ozon ist eine hochreaktive Substanz und zerfällt sehr leicht unter Abgabe eines Sauerstoffatoms - in hoher Konzentration auch explosionsartig. (Darüber berichtet unsere Webseitensammlung zum Ozon.)
Die falsche Vorstellung rührt von Folgendem her: Viele verbinden mit dem Begriff der Mesomerie einen absolut niedrigen Energieinhalt des Zustands und damit verbunden hohe Stabilität und fehlende Reaktivität des mesomeren Moleküls. Diese Leute leiten ihre klassische Vorstellung bezüglich der Mesomerie vom Benzol her. Benzol ist wirklich energiearm und stabil - auch im landläufigen Sinn.
Man muss die tatsächliche Stabilität und Energie"armut" stets im Vergleich zu
nichtmesomeren Strukturen (Grenzstrukturen) der gleichen Substanz prüfen.
Zur Erinnerung: Die Eigenschaft des Benzols vergleicht man mit denen des
theoretischen Cyclohexatriens.
Diese Substanz ist in der Theorie sehr hochenergetisch und gegenüber
elektrophilen Additionsreaktionen instabil, weil sie formal drei lokalisierte
Doppelbindungen im Ring hat, sich also wie ein Alken verhalten sollte. Davon
müsste es auch zwei verschiedene Grenzstrukturen geben, die sog. Hückel-Strukturen.
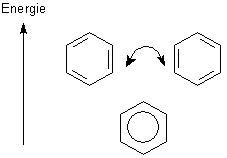
Der reale Benzolring erweist sich dagegen gegenüber elektrophilen Additionsreaktionen
als hochstabil, weil seine Elektronen delokalisiert sind. Außerdem gibt es (wie
Zweitsubstitutionen zeigen) keine zwei alkenische Hückel-Strukturen, sondern nur
eine Benzolstruktur.
Die Grenzzustände des Cyclohexatriens mit in drei Doppelbindungen lokalisierten
Elektronen, also den Alkencharakter, kann man erreichen, indem man Energie
zuführt, zum Beispiel durch UV-Bestrahlung.
Beim Ozon vergleicht man den mesomeren Zustand (wie das Bild oben zeigt) mit den zwei Lewis-Strukturen, bei denen es zu inner-molekularen Ladungstrennungen kommt. Die sind sehr hochenergetisch - aber eben nur als Grenzstrukturen theoretisch vorhanden (oder durch UV-Strahlungszufuhr zu erreichen). Die mesomere Form (positive Partialladung am mittleren O-Atom und negative Partialladungen an den endständigen O-Atomen) ist tatsächlich "energieärmer". Aber das heißt nicht etwa, dass Ozon deshalb (entsprechend dem Benzol) inert wie ein toter Hund ist!
Weitere Texte zum Thema „Ozon“