| Klick mich an! |
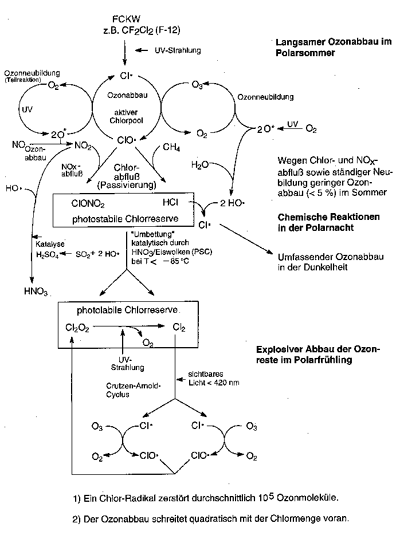 |
| Reaktionsmechanismus des Ozonabbaus |
Für Interessierte: Wie das
Ozonloch entsteht
In jedem Frühling gibt es Zeitungsmeldungen über das Ozonloch am Nordpol und im Herbst über das
am Südpol.
Merkwürdig ist, dass die Zerstörung
des Ozons in der Polarnacht und vor allem hauptsächlich zu Beginn des jeweiligen Polarfrühlings
stattfindet. Die Chloratome, die bekanntlich das Ozon abbauen,
können sich doch nur unter Sonnenbestrahlung aus den FCKW
bilden! Warum reißt das Ozonloch nicht in der vollen Strahlung
der Sommersonne auf? Wie kann man das erklären?
|
Ozonschwund über der Antarktis hat
sich verstärkt Ozonloch bereits so groß wie Europa 13.09.1995 |
|
Genf (dpa). Das Ozonloch über
der Antarktis ist in diesem Jahr so groß wie nie zuvor.
Die schützende Schicht sei in einem Gebiet der Größe
Europas stark geschädigt, warnte die Weltorganisation für
Meteorologie (WMO).
Damit ist das Ozonloch über dem Südpol, das sich Ende Juli öffnete, doppelt so groß wie 1993 und 1994 zur gleichen Zeit. In diesen beiden Jahren hatten die Wissenschaftler schon die bislang tiefsten Ozonwerte seit Beginn regelmäßiger Messungen registriert. Im August 1995 waren die Ozonwerte über der Antarktis nochmals zehn Prozent niedriger als die Rekordwerte des vergangenen Jahres, teilte WMO-Experte Botschkow mit. Das habe sich im September fortgesetzt. |
|
Ozonloch über Europa groß wie
nie 13.03.1996 |
| Bonn (AP). Das Ozonloch über Europa war in diesem Winter so groß wie nie zuvor. Das bestätigte die Sprecherin des Bundesforschungsministeriums, Maria Reuter, gestern in Bonn. Laut Reuter sind in diesem Jahr 37 Prozent weniger Ozon in der Stratosphäre über Europa als in den vergangenen Wintern. Die Ozonschicht schützt Mensch und Natur vor den schädlichen ultravioletten Strahlen der Sonne. |
Außerdem soll der Ozonabbau etwas mit Abkühlung der Stratosphäre und dortiger Wolkenbildung zu tun haben.
Um das alles zu verstehen, ist es notwendig, die chemischen Reaktionen während der einzelnen Jahreszeiten genauer zu betrachten.
1) Sommerreaktionen
Ozon schützt die Lebewesen auf der
Erde vor zu starker UV-Strahlung von der Sonne.
Gehen wir einmal von der Mischung aus, die im Sommer einen großen Teil der UV-Strahlung absorbiert.
Sauerstoffmoleküle werden durch UV-Strahlung
in Atome gespalten. Ozon bildet sich ständig in exothermer
Reaktion aus Sauerstoffmolekülen und freien Sauerstoffatomen.
Bei Bestrahlung zerfällt Ozon wieder in diese Bausteine,
bildet sich daraus wieder neu (usw.). Auf diese Weise wird in
der Stratosphäre die UV-Strahlung langsam in Wärme umgewandelt.
Daher steigt die Temperatur in der Stratosphäre wieder an.
Soll ein Stoff den Ozongürtel schädigen, muss er zunächst einmal das Ozonmolekül durch Übernahme
des dritten labilen O-Atoms spalten. Außerdem muss
die Rückbildung des Ozons durch Abfangen der freien Sauerstoffatome
verhindert werden. Das ist bereits das Schema, wie Chloratome
zum Ozonloch beitragen.
Die Chloratome bilden bei Reaktion mit Ozon Chloroxomoleküle, die die Neubildung von Ozon durch
Abfangen von freien Sauerstoffatomen unterbinden.
Wirksam sind übrigens auch die aus der Troposphäre stammenden Stickoxide ("NOx").
Das Stickstoffmonooxid NO wirkt dabei wie Chlormonooxid ClO, indem es die Neubildung von
Ozon durch Abfangen von freien O-Atomen verhindert.
| Klick mich an! |
 |
| Reaktionsmechanismus des Ozonabbaus |
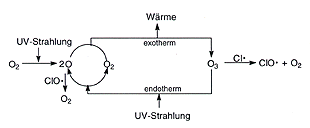
Sommerreaktionen des Ozons in der Stratosphäre
Gegen die Ozonzerstörung wirkt jedoch die UV-Strahlung der Sonne, durch die Ozon ständig neu gebildet
und die Ozonschicht ständig "repariert" wird.
(Auch Stickoxide können wie es auch in Bodennähe der Fall ist, unter bestimmten Bedingungen die
Ozonschicht aufbauen helfen: Stickstoffdioxid überträgt
dann ein Sauerstoffatom auf ein Sauerstoffmolekül.)
Es gibt also mehrere Möglichkeiten zum Aufbau und zum Abbau von Ozon. Letztere werden aber nicht
voll genutzt. Der Hauptgrund für den geringen Ozonabbau im
Sommer ist nämlich, dass die aktiven Chloratome, Chloroxomoleküle
und Stickoxide durch andere Reaktionen unter Bildung von Verbindungen
wie Chlorwasserstoff HCl, Chlornitrat ClONO2 und Salpetersäure
HNO3 inaktiviert werden. (Daran sind noch Methan CH4,
Wasserdampf und Schwefelsäure H2SO4
beteiligt.) Diese Verbindungen sind gegen UV-Strahlung stabil,
setzten also keine Chloratome oder Stickoxide frei und bauen Ozon
deshalb nicht mehr ab. Sie sammeln sich den ganzen Sommer über
in den 15-16 km hoch gelegenen polaren Stratosphärenwolken
("PSC"), die vor allem aus Salpetersäure- und Schwefelsäure-Eis
bestehen. (Diese kann man in Skandinavien bei Sonnenuntergang
sehr gut sehen. Wegen ihres Schimmers nennt man sie Perlmuttwolken.)
Die gesamte sommerliche Ausdünnungsrate beträgt deshalb "nur" etwa 5 % und hängt von der regionalen
Konzentration an FCKW sowie Stickoxiden ab.
2) Winterreaktionen
Wenn nun die lange Polarnacht hereinbricht, geht der Ozonabbau durch Chlor-Atome in der Dunkelheit ohne Ozon-Neubildung
weiter. Dabei werden durch HO-Radikale an den Oberflächen
der PSC ständig Chloratome aus ansonsten passiven HCl-Molekülen
nachgebildet:
HCl + HO · ———> Cl · + H2O
(Die HO-Radikale stammen aus der Reaktion von Wassermolekülen mit Ozonmolekülen oder Sauerstoffatomen.)
Somit verfügen die PSC auch in der Dunkelheit über ein besonders hohes Ozonabbau-Potential.
Diese winterliche Ozonausdünnung stört weniger, da davon
wegen fehlender UV-Strahlung für Lebewesen keine Bedrohung
ausgeht.
3) Reaktionen im Frühjahr
Der Rest des Ozons wird zu Frühlingsbeginn durch folgende Mechanismen zerstört, die zugleich auch seine
Neubildung über eine lange Zeit hinweg verhindern:
In der Polarnacht kühlt die Stratosphäre stark aus. Bei Temperaturen unter -85 °C setzen in den PSC
merkwürdige chemische Prozesse ein, durch die die strahlungsstabile und daher gegenüber Ozon passive Chlorverbindungen
in strahlungslabile und daher ozonabbauaktive Verbindungen wie Chlor Cl2,
unterchlorige Säure HClO und vor allem Dichlordioxid Cl2O2
(besser: ClO-OCl) umgebildet werden. Diese Reaktionen laufen bevorzugt
an den Kristalloberflächen der gefrorenen Salpetersäure
ab; letztere wirken also als Katalysatoren.
Wenn der Polarfrühling einsetzt, wird durch die ersten Strahlen der über den Horizont auftauchenden
Sonne diese Chlorreserve mit einem Schlag zersetzt. Es bilden
sich riesige Mengen an Chloratomen und Chloroxomolekülen;
die Zerstörung des Ozons beginnt. Bei diesen Chlormassen
ist der Reaktionsmechanismus etwas anders als im Sommer. Ein Chloratom
zerstört 100.000 bis 300.000 Ozonmoleküle, bis es schließlich
selbst vernichtet wird! Pro Tag werden etwa 5 % des Ozons abgebaut;
nach zwei Wochen sollten bereits 50 % vernichtet sein. Da aber
gleichzeitig Ozon neugebildet wird, wird dieser Wert erst nach
drei Wochen erreicht. Allerdings haben die Moleküle des nachgebildeten
Ozons wegen der großen Chlormenge keine besonders große
Überlebenschance. Das "Ozonloch" reißt auf.
Bei Verdoppelung der Chlorkonzentration beobachtet man eine Vervierfachung des Ozonabbaus. Das Verbot von FCKW ist deshalb durchaus sinnvoll.
4) Langfristige Entwicklungen
Zur Bildung des Ozonlochs sind also die Stratosphärenwolken aus Eis notwendig. Wenn das Ozon fehlt,
kann es auch keine UV-Strahlung mehr in Wärme umwandeln.
Dadurch kühlt die Stratosphäre noch mehr aus, es bilden
sich mehr Eiswolken (usw.). Deswegen gelangt mehr UV-Strahlung
zum Erdboden und wandelt sich dort in Wärme um; die untere
Atmosphäre heizt sich zusätzlich auf, und der Treibhauseffekt
verstärkt sich. Da aber durch ihn die Stratosphäre auskühlt,
verstärken sich wieder die Höhenwolken, das Ozonloch
reißt noch weiter auf. Man weiß heute, dass sich
Ozonloch und Treibhauseffekt gegenseitig aufschaukeln
[ 15 ].
Wie Ozonzerstörungspotential und Beitrag zum Treibhauseffekt zusammengehören, zeigt die folgende Tabelle.
| Ozonzerstörungspotential und Treibhauseffekt | ||||
| Verbindung | Lebensdauer (Jahre) |
GWP (20 J.) |
ODP | CLP |
| CO2 | 120 | 1 | - | - |
| F-11 (CCl3F) |
60 | 4500 | 1 | 1 |
| F-12 (CCl2F2) |
120 | 7100 | 1 | 1,5 |
| H-FCKW 22 (CHClF2) |
15 | 4100 | 0,05 | 0,14 |
| H-FKW 134a (CF3-CH2F) |
16 | 3200 | 0 | 0 |
Abkürzungen:
| GWP: | Global Warming Potential = |
| Beitrag zum Treibhauseffekt | |
| ODP: | Ozone depletion Potential = |
| Ozonzerstörungspotential | |
| CLP: | Chlorine Loading Potential = |
| Chlorbelastungspotential |
Weitere Texte zum Thema „Ozon“