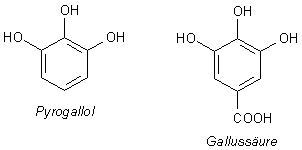
Pyrogallol
Experimente:
Versuch: Pyrogallol bindet Sauerstoff
Versuch: Pyrogallol reduziert Silber-Ionen
Versuch: Chemolumineszenz bei der Oxidation von Pyrogallol
Pyrogallol ist das dreiwertige Phenol, bei dem die drei OH-Gruppen benachbart sind:
Pyrogallol entsteht beim Erhitzen von Gallussäure. Darauf weist auch sein Name hin: griech. pyr, Feuer; gall- von Gallussäure (eigentlich von gelb, stammt aber von "bitter wie die gelbe Galle"); -ol steht für einen Alkohol.
Pyrogallol - Ein Stoff, der Luft frisst
Pyrogallol-Lösung bindet nach Laugenzusatz den gasförmigen Sauerstoff energisch an sich.
Dabei zerfällt das Pyrogallol und färbt die Lösung tiefbraun. Diese Eigenschaft wird in der Gasanalyse
benutzt, denn man kann aus abgeschlossenen Gemischen den Sauerstoff mit Hilfe von Pyrogallol vollständig
herausziehen. Die Absorption von Sauerstoff in einem geschlossenen System erzeugt sogar einen Unterdruck
in diesem System. Deswegen steigt im Versuch das Wasser im Glasrohr.

Bild 1 (Foto: Helene)
Reduzierende Eigenschaft von Pyrogallol
(-> Versuch)
Pyrogallol ist ein sehr gutes Reduktionsmittel, ähnlich dem Hydrochinon.
Anders als Hydrochinon reduziert es Silber-Ionen bereits in neutraler Lösung. Daher dient Pyrogallol
auch als fotografischer Entwickler.
Das chemische Leuchten
Bei der Oxidation von Pyrogallol mit Sauerstoff wird Energie nicht nur in Form von Wärme, sondern vor
allem in Form von sichtbarem Licht abgegeben (-> Versuch). Dieses Phänomen nennt man
Chemolumineszenz. (Ein solches "kaltes Licht" sieht man auch zum Beispiel bei der
Oxidation von Luminol.)
Bild 2 (Foto: Helene)
Die Reaktionsgleichung der Oxidation von Pyrogallol durch Wasserstoffperoxid lautet:
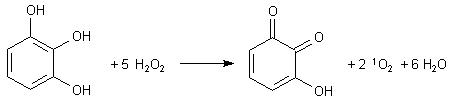
Dabei symbolisiert "1O2" eine besondere Elektronenkonfiguration des Sauerstoffmoleküls, den Singulett-Sauerstoff. Im Gegensatz zum "normalen" Triplett-Sauerstoff (3O2) hat der Singulett-Sauerstoff zwei gepaarte Elektronen in seinen p*-Molekülorbitalen, d. h. in den antibindenden Orbitalen. In seinem Grundzustand liegt das Sauerstoffmolekül im Triplett-Zustand. Der Singulett-Sauerstoff ist eine angeregte Form des Sauerstoffmoleküls und liegt bei einer höheren Energie.
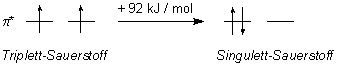
Woher kommt nun das Licht? Bei der Oxidation von Pyrogallol entsteht zunächst Singulett-Sauerstoff. Dieser wandelt sich dann langsam unter rötlicher Lumineszenz in den "normalen" Triplett-Sauerstoff um:
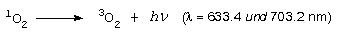
Oft gefragt: Warum gibt man der Reaktionsmischung zur Chemolumineszenz
von Pyrogallol Formaldehyd zu?
Dazu findet man in der Literatur nichts. Zu vermuten ist Folgendes: Das Oxidationsmittel Wasserstoffperoxid
ist gar nicht so energisch, wie man im Allgemeinen meint. Vor allem gilt dies für das alkalische Milieu, in dem
die Reaktion ablaufen muss, da sich bei der Oxidation von Pyrogallol Protonen bilden, die abgefangen werden müssen,
um die Oxidation voranzutreiben. Zur Erinnerung: Wasserstoffperoxid ist vor allem im sauren Milieu wirksam.
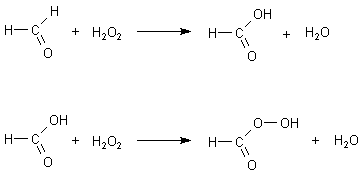
Die Oxidationskraft von H2O2 wird jedoch deutlich verstärkt, wenn man zur Reaktionsmischung
Carbonsäuren hinzugibt. Es bilden sich rasch Peroxocarbonsäuren, die schon bei Zimmertemperatur Radikale wie HO·
und HO2· bilden. Dies sind die eigentlichen Oxidantien, die die Chemolumineszenz
auslösen.
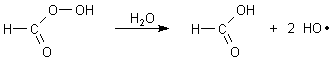
Nun muss (wie schon gesagt) bei der angesprochenen Reaktion alkalisches Milieu gewährleistet sein. Deshalb kann man nicht einfach Carbonsäuren hinzugeben. Anders aber ist es mit dem Formaldehyd: Ein Teil des Wasserstoffperoxids oxidiert diesen nach und nach zu Ameisensäure; es bildet sich daraus mit überschüssigem Wasserstoffperoxid die hochreaktive Peroxo-Ameisensäure, die die gewünschten Radikale bildet.
(Übrigens geht man so auch zur Verstärkung der Wirkung von Bleichmitteln in Vollwaschmitteln vor. Hier spielt vor allem die Essigsäure, die aus Bleichmittelaktivatoren entsteht, eine zentrale Rolle.
Erinnert sei auch an die Chemie von Carbamidperoxid.)
Zur Chemie mit Wasserstoffperoxid haben wir eine große
Webseitengruppe.
Weitere Texte zum Thema „Phenole“