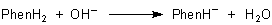
Das Phenolphthalein-Molekül in schwach alkalischem Milieu:
Jetzt wird es bunt
Experimente:
Klicke hier
In schwach alkalischem Milieu (pH > 7) gibt eine phenolische Hydroxylgruppe des Phenolphthaleins
ein Proton ab. Ein zunächst lactoides Mono-Anion entsteht.
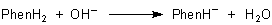
Es baut sich ein Gleichgewicht mit einer chinoiden Form auf, indem sich der Lactonring öffnet. Das
zentrale C-Atom wird dabei sp2-hybridisiert.
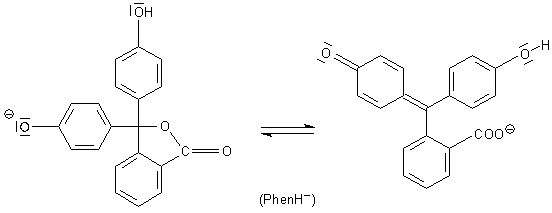
Gleichgewicht zwischen der chinoiden Form des farblosen Mono-Anions
und seiner lactoiden Form
Das resultierende Molekül ist insgesamt planar und hat eine chinoide Struktur. Es ist aber noch farblos, denn es kann sich keine Mesomerie zwischen den beiden oberen Phenolringen ausbilden. Grund: Es fehlt in diesem Bereich eine freie Ladung, die wandern könnte. Aus diesem Grund kann sich auch die lactoide Form zurückbilden.
Erst wenn auch die zweite phenolische Hydroxylgruppe (beginnend mit pH-Werten um 8) ihr Proton abgegeben hat, ist die mesomere Wechselwirkung zwischen den beiden oberen Ringen möglich.
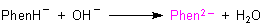
Auf diesem chinoiden Di-Anion beruht die bekannte purpurrote Färbung der Lösung. Man
erkennt die für die Farbigkeit „verantwortlichen“ Chromophore und Antichromophore, zwischen
denen eine negative Ladung „schwingt“.
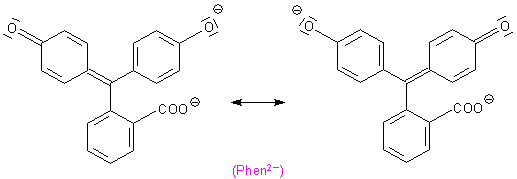
Mesomere Grenzstrukturen des Di-Anions in alkalischem Milieu
(Purpurrote chinoide Form)
Der Lactonring kann sich wegen der Mesomerie nicht wieder schließen, denn es stehen keine Elektronen zum
nucleophilen Angriff auf das C-Atom des Carboxylrestes zur Verfügung.
Weitere Texte zum Phenolphthalein