
Phenolphthalein als Säure/Base-Indikator
Experimente:
Versuch: Wie Phenolphthalein mit verschiedenen Säuren und Basen reagiert
Versuch: Salzlösungen und Phenolphthalein
Versuch: Säure/Base-Titrationen mit Phenolphthalein als Indikator
Weitere Experimente mit Phenolphthalein

Olga titriert mit Phenolphthalein
(Foto: Daggi)
Beachtenswerte Besonderheiten von Titrationen mit Phenolphthalein
Wenn man mit Phenolphthalein als Indikator arbeiten will, muss man an einiges denken. Hierzu haben wir eine
besondere Webseite eingerichtet. Hier wollen wir aber schon einige Punkte ansprechen.
Phenolphthalein ist der Säure/Base-Indikator schlechthin. Sein Farbumschlag setzt aber erst ab pH-Wert 8,2 ein und wird bei pH 10 so richtig deutlich sichtbar. (Klicke hier.)
Kann man dann überhaupt mit Phenolphthalein die Endpunkte von Titrationen jeglicher Säure erfassen?
Zunächst machen wir kleine Vorversuche
Wir untersuchen, wie sich verschiedene Säure- und Baselösungen gegenüber Phenolphthalein
verhalten (-> Versuch).
Dann prüfen wir noch, wie sich Salzlösungen und Phenolphthalein verhalten (-> Versuch).
Titration von starken Säuren
Eine Lösung von Natriumchlorid reagiert neutral und färbt deshalb nicht eine Lösung von Phenolphthalein. Kann
man dann überhaupt starke Säuren wie die Salzsäure mit Phen als Indikator titrieren? Das geht!
Obwohl Phenolphthalein erst oberhalb des Neutralpunkts umschlägt, sind die starken Säuren zwar bekanntlich schon bei pH 7 „austitriert“. Denn deren Titrationskurve schnellt im Bereich des Neutralpunkts pH 7 bei Zugabe eines einzigen überschüssigen Tropfens Lauge derartig schnell von pH 4 auf pH 10 hoch, dass man diesen Titrierfehler vernachlässigen kann.
Klick mich an!
Titrationskurve einer starken und einer schwachen Säure
(Essigsäure und Salzsäure; Vorlage jeweils 30 ml; c = 0,1 mol/l)
Titration von schwachen Säuren
Dagegen haben viele schwache Säuren wie zum Beispiel die Essigsäure
einen Äquivalenzpunkt, der deutlich über dem Neutralpunkt des Wassers liegt. Deren Titrationskurve
schnellt bei pH 4 auch nicht auf pH 10 hoch, weil um pH 5 ja gerade der Pufferbereich der Essigsäure
liegt. Ihr Äquivalenzpunkt ist außerdem nicht der Neutralpunkt des Wassers. Er liegt nämlich nicht bei pH 7,
sondern bei pH 8,9. Das ist zugleich der pH-Wert einer verdünnten Natriumacetatlösung.
Die reagiert alkalisch, weil das Salz der schwachen Essigsäure mit Wasser eine Protolysereaktion
eingeht.
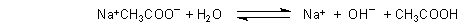
Damit sehen wir, dass der Einsatz von Phenolphthalein als Indikator gerade bei der Titration vieler schwacher
Säuren vorteilhaft ist.
Titration von starken Basen
Starke Basen wie die Natronlauge sind (wie starke Säuren) kein Problem. Hier ist nur alles umgekehrt. Die Lösung
ist zu Beginn der Titration rot. Man muss aber nach Zugabe der Phenolphthalein-Lösung schnell mit der Titration beginnen,
denn die Purpurfärbung ist nicht stabil, wenn die Lösung alkalisch ist. (Klicke hier.)
Titriermittel ist natürlich Salzsäure. Ab pH 10 sinkt die Titrationskurve plötzlich auf pH 4 ab. Sie entfärbt sich bei
Säurezugabe rasch, wenn die Lösung austitriert ist.
Titration von schwachen Basen
Und wie ist es bei Basen? Wir haben gesehen, dass Ammoniumchloridlösungen nicht mit Phenolphthalein reagieren.
Deshalb sollten wir Basen wie Ammoniak ebenfalls mit Phenolphthalein als Indikator titrieren können.
Nun können wir endlich richtig lostitrieren (-> Versuch).
Weitere Texte zum Phenolphthalein