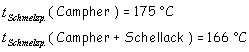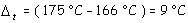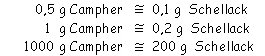Versuch: Bestimmung der Molmasse von Schellack
Schülerversuch; 30 min.
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Geräte
Thermometer 200 °C, großes Reagenzglas, Glühröhrchen, Draht, Bunsenbrenner, Stativmaterial, Waage.
Chemikalien
Campher (F, Xi), Schellack, Paraffinöl.
Durchführung
Wiege 500 mg Campher und 100 mg Schellack ab. Fülle beides in
das Glühröhrchen und befestige es mit Draht am unteren Ende des
Thermometers. Häng das Thermometer, wie es in den Bildern zu sehen ist,
in das mit Paraffinöl zur Hälfte gefüllte, große Reagenzglas, so
dass es ca. 1 cm über den Flüssigkeitsspiegel herausragt.
Erhitze möglichst langsam. Wenn das Gemisch geschmolzen
ist, lösche die Flamme und beobachte das geschmolzene Gemisch.
Sobald sich wieder Kristalle bilden, notiere die Temperatur.

Wiederhole den Versuch mit reinem Campher. |
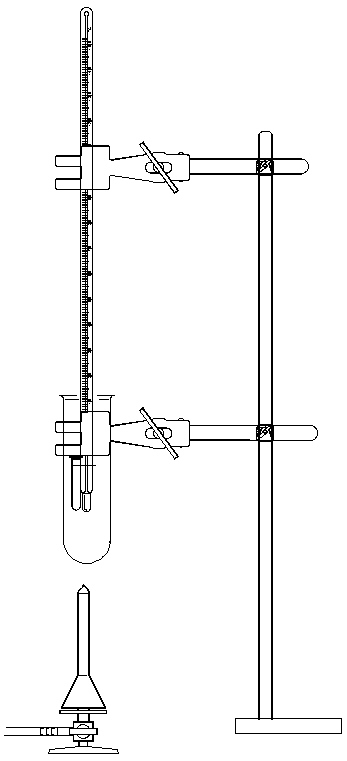 |
Foto / Zeichnung:Dietmar |
Auswertung einer Messung
Lese vor der Auswertung am besten den Text über die Kryoskopie.
Folgende Werte sind bei einer Versuchsreihe bestimmt worden:
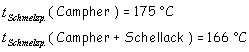
Die Erniedrigung des Schmelzpunktes beträgt demnach:
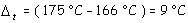
Da die molare Schmelzpunkterniedrigung von Campher 39,7 °C
pro Kilogramm beträgt, muss auf eine Masse von
einem Kilogramm hochgerechnet werden.
In 0,5 g Campher wurden 0,1 g Schellack gelöst:
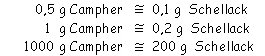
200 g Schellack zu einem Kilogramm Campher gemischt, lassen den
Schmelzpunkt des Camphers um 9 °C fallen.
Um die Masse von einem Mol Schellack bestimmen zu können, muss
auf eine Temperaturerniedrigung von 39,7 °C umgerechnet werden.

Die durchschnittliche Molmasse dieser Probe Schellack beträgt ca. 882 g / mol. (Da es sich
bei Schellack um einen Naturstoff handelt, können die ermittelten Werte stark schwanken.)
Hintergründe zum Experiment
Diese Seite ist Teil eines großen Webseitenangebots
mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 11. Januar 2005, Dagmar Wiechoczek