Benzaldehyd - das Versprechen nach Marzipan
Experimente:
Versuch: Benzaldehyd in Pflanzen
Versuch: Oxidation von Benzaldehyd zu Benzoesäure
Benzaldehyd - ein aromatischer Aldehyd
Die Mandel hat’s, Pflaume und Pfirsiche haben's auch - ein Geruch des Kerns nach Bittermandel.
Auch beim Zerreiben von Kirschlorbeerblättern fällt er sofort auf. Es ist ein ganz besonderes Aroma.
Wer kennt ihn nicht, diesen Geruch! Gelangt er an die Nase, reagiert der Körper sofort. Der
Speichelfluss nimmt zu, das Verlangen wird größer, und es stellt sich ein unbestimmtes Hungergefühl
nach etwas Süßem ein. Alles lediglich auf Grund eines einfachen Geruchs: Leckeres Marzipan!
Der Mensch ist in der Lage, mehrere tausend Gerüche wahrzunehmen und voneinander zu unterscheiden. Die meisten Duftstoffe sind organische Verbindungen, so auch der Duft nach Bittermandeln. Die Verbindung, die diesem Geruch zu Grunde liegt, ist der kleinste aromatische Aldehyd: Benzaldehyd.

Wir verstehen nun, woher die organisch-chemische Verbindungsklasse der Aromaten ihre Bezeichnung hat. In ihr versammeln sich viele natürliche Aromastoffe. Das bekannteste und süßeste Beispiel: Vanillin - übrigens auch ein Aldehyd!
Vanillin
So besitzt auch Benzaldehyd eine ganz besondere Duftnote, wir sagen fälschlich "Geschmack" - eben nach Marzipan. (Wir verwechseln den Geruch immer mit Geschmack. Wir schmecken bekanntlich kein Marzipan, sondern wir riechen es.)
Glykoside sind die Ausgangsstoffe für Blausäure und Benzaldehyd
Benzaldehyd ist eine ölige Flüssigkeit. Sie ist bekannt unter der Trivialbezeichnung Bittermandelöl.
In den Bittermandeln kommt der Aldehyd als Glykosid gebunden vor. Dieser und ähnliche Stoffe sind auch im
Kirschlorbeer vorhanden.
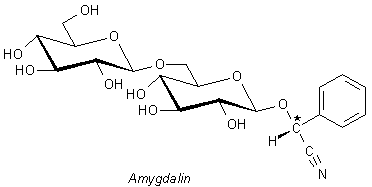
Wir erkennen schon beim flüchtigen Hinsehen, dass die Moleküle der Glykoside einen Cyanid-Rest enthalten. Dieser ist recht locker gebunden. Deshalb spricht man auch von cyanogenen Glykosiden. 1000 g Bittermandeln setzen 3 g Blausäure frei! Mit fünf Bittermandeln sowie mit etwa zehn Kernen der "Kirschen" vom Kirschlorbeer kann man ein Kind umbringen.
Hinter den cyanogenen Glykosiden steckt eine Verbindungsgruppe, die a-Hydroxynitrile (besser bekannt als Cyanhydrine). Diese bilden sich in einer Gleichgewichtsreaktion mit Blausäure aus Aldehyden bzw. Ketonen.
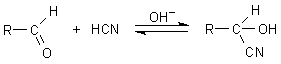
Bildungsreaktion der Cyanhydrine im Labor
Zum Thema haben wir einen Tipp des Monats mit ausführlichen Experimentiervorschriften zum schulgemäßen Untersuchen der beteiligten Substanzen. Da gehen wir auch auf den Geruch von Benzaldehyd ein - schließlich riecht der Aldehyd auch wie Blausäure!
Ein kurzer chemischer Steckbrief des Benzaldehyds
Benzaldehyd ist der kleinste aromatische Aldehyd. Hergestellt wird er wie alle Aldehyde über die Oxidation
des entsprechenden Alkohols. Mögliche Oxidationsmittel sind hierbei unter anderem schwefelsaure Kaliumdichromat-
bzw. Kaliumchromatlösung oder auch Kupferoxid. Die Reaktion von Benzylalkohol zu Benzaldehyd kann allerdings auch
schon an der Luft ohne weiteres stattfinden.
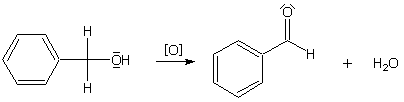
Oxidation von Benzylalkohol zu Benzaldehyd
Nicht nur durch seinen aromatischen Charakter nimmt Benzaldehyd eine besondere Stellung unter den Aldehyden ein, sondern auch dadurch, dass er in der Nachbarschaft zur Carbonylgruppe kein CH-acides Wasserstoffatom besitzt. An seiner Stelle befindet sich der Benzolring. Dieser Unterschied hat zur Folge, dass die für Aldehyde im alkalischen Milieu ansonsten typische Aldoladdition ausbleibt. Stattdessen läuft wie beim Formaldehyd die Cannizzaro-Reaktion ab.
Die Nachbarschaft den Benzolrings ist auch der Grund dafür, dass die Fehling-Probe als für Aldehyde typische Nachweisreaktion nicht funktioniert. Dagegen ist der Nachweis mit ammoniakalischer Silbernitratlösung (Tollens Reagenz) ist positiv.
Länger gelagerter Benzaldehyd (wie z. B. in der Form von so genanntem künstlichen Mandelöl) bildet vor allem im Licht und bei Luftzutritt (also bei einmal geöffneten Gebinden) gefährliche Peroxide. Dadurch wird Benzaldehyd mit der Zeit oxidiert. Das ist die Ursache für die Bildung eines weißlichen Niederschlags. Es handelt sich um Benzoesäure. Zu Bildung von Benzoesäure aus Benzaldehyd haben wir einen Versuch.
Weitere Texte zum Thema „Aldehyde und Ketone“