
Aldehydhydrate
Reaktionen von Carbonylverbindungen mit Wasser
Carbonylverbindungen können durch Nucleophile angegriffen werden. Der Angriffspunkt ist das
positiv polarisierte C-Atom der Carbonylgruppe. Besonders angriffslustig sind Hydroxylverbindungen.
Die kleinste stabile Hydroxylverbindung ist das Wasser.

Reaktion von Aldehyden oder Ketonen mit Wasser
Betrachtet man die Reaktionsgleichung, so fällt auf, dass das Produkt eigentlich gar nicht existieren dürfte. Denn bei solch einer Konstellation möchte sich sofort wieder ein Molekül Wasser als energetisch günstigste Konstellation bilden. Denn die Erlenmeyerregel besagt: Ein C-Atom, welches zwei Hydroxylgruppen trägt, ist nicht stabil. Was ist der Grund? Das fördert die Entropie.
Legt man diese Regel zugrunde, dann wäre die obige Reaktionsgleichung nicht richtig.
In die Erörterungen muss man jedoch einbeziehen, dass es sich bei der Hydratbildung um eine Gleichgewichtsreaktion handelt. Das Hydrat wird zwar gebildet - aber es zerfällt wieder und entsteht gleichzeitig immer wieder neu. Damit ist die dargestellte Reaktion also möglich - allerdings nur in wässrigem Milieu und außerdem nur in begrenztem Umfang, der durch die Gleichgewichtskonstante bestimmt wird. Isolieren kann man dieses Produkt allerdings nicht. Beim Eindampfen der Lösungen würden sofort Wassermoleküle abgespalten.
(So etwas gibt es auch im chemischen Alltag - denken Sie an die instabile Kohlensäure oder Schweflige Säure.)
Redoxreaktionen der Carbonyle - nicht ohne Hydratbildung
Dennoch ist die Bildung von Aldehydhydraten wichtig. Oxidationen in wässrigen Lösungen zum
Beispiel gehen vom Hydrat aus. Das betrifft auch die biochemischen, durch Enzyme katalysierten
Redox-Veränderungen. Wir beschreiben dies ausführlich in der Webseite "Redoxreaktionen
von Carbonylverbindungen setzen eine Addition voraus".
Chloral - das stabile Aldehydhydrat
Chloral-Hydrat ist ein Schlafmittel, das es heute nicht mehr zu kaufen gibt, denn damit haben
sich zu viele Leute umgebracht. Es wirkt als Narkotikum - wie alle lipophilen Halogenverbindungen.
CCl3-CHO · H2O = CCl3-CH(OH)2
Die chemische Bezeichnung für Chloral ist Trichloracetaldehyd-Hydrat. Wieso kann es als Hydrat so stabil sein, dass es sogar als Reinsubstanz isolierbar ist und dass man es in Tablettenform kaufen konnte?
Der Grund: Die elektronegativen Chloratome üben einen starken Elektronenzug auf die C-Atome des Aldehyds aus. Sie verringern dort die Elektronendichte. Das bezeichnet man durch das Symbol (-I)-Effekt. Damit wird das C-Atom der Carbonylgruppe stärker als im normalen Acetaldehyd positiv polarisiert. An dieser Stelle kann ein Wassermolekül als Nucleophil andocken.
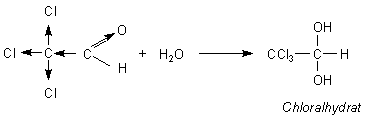
Und was ist mit Alkoholen als Hydroxyl?
Hier bilden sich stabile Substanzen, die Halbacetale sowie
Vollacetale. Der Grund für die Stabilität liegt im (+I)-Effekt der
Kohlenstoffkette des angedockten Alkohols. Damit ist die Abspaltungstendenz geringer als bei den
Hydraten - aber auch diese Reaktionen sind Gleichgewichtsreaktionen!
Weitere Texte zum Thema „Aldehyde und Ketone“