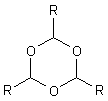
Allgemeine Struktur eines Aldehyd-Trimers
Aldehyde können auch fest werden - Polymerisation
Experimente
Versuch: Herstellung von Acetaldehyd aus Paraldehyd oder Metaldehyd
Wenn man die schon lange im Schullabor stehende Flasche mit konzentrierter Formaldehydlösung
(Formalin) betrachtet, so erkennt man, dass sich darin oftmals ein farbloser Niederschlag
gebildet hat. Viele meinen, das sei ein Oxidationsprodukt des Aldehyds. Aber das heißt
Ameisensäure und ist zudem auch noch flüssig. Hier handelt es sich um ein Polymerisat.
Aldehyde und ihre Trimere
Aldehyde besitzen auf Grund ihrer Struktur die Möglichkeit, intramolekular (also mit
weiteren Molekülen) über ihren Sauerstoff eine Verbindung einzugehen. Häufig handelt es
sich hierbei um eine Trimerisation, also eine Reaktion von drei Molekülen. Es entsteht ein
Ring, ein Sauerstoff-Heterocyclus. Eine solche Ringverbindung ist so aufgebaut, dass sich
ein Kohlenstoffatom immer mit einem Sauerstoffatom im Ringverbund abwechselt. Vergleicht
man die unterschiedlichen Aldehyde und ihre Trimere, so erhält man eine regelmäßige Struktur.

Allgemeine Struktur eines Aldehyd-Trimers
Es handelt sich um eine spontane Selbstaddition. Hierbei wird die Doppelbindung zwischen Sauerstoff- und Kohlenstoffatom geöffnet und umgelenkt.
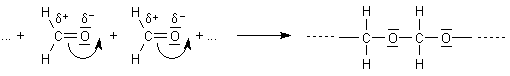
Von Bedeutung sind hauptsächlich die Polymere des Formaldehyds (R = H) und des Acetaldehyds (R = CH3).
In diesem Zusammenhang sei auch an die Polyether (POM) erinnert, die auf der Selbstpolymerisation von Formaldehyd beruhen.
Formaldehyd bildet Ketten und einen Ring
Beim völligen Eindampfen einer wässrigen Formaldehyd-Lösung bleibt ein weißer Festkörper übrig,
Paraformaldehyd. Dabei handelt es sich hauptsächlich um kettenförmige Polymere. Die
Reaktion ist bei 180-200 °C umkehrbar. Das Monomer kann somit zurückgewonnen werden.
HOCH2-(OCH2)n-O-CH2OH
Destilliert man dagegen Formaldehydlösung in Gegenwart von 2%iger Schwefelsäure, so bildet sich das oben erwähnte cyclische Trimere, 1,3,5-Trioxan. Das ist eine farblose, kristalline Substanz, die aus dem Reaktionsgemisch extrahiert werden kann. Durch Wärmezufuhr unter Säureeinwirkung ist diese Reaktion umkehrbar.
Einen Einsatz findet das Trioxan - wie schon gesagt - bei der Herstellung des Polyether-Kunststoffs Polyoxymethylen (POM).
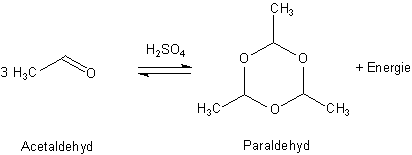
Acetaldehyd bildet zwei Arten von Ringen
Acetaldehyd polymerisiert in stark exothermer Reaktion zu unterschiedlichen Ringsystemen. Hierbei kommt es
im Wesentlichen zu einer Verbindung von drei bzw. vier Molekülen. Beide Reaktionen finden im Beisein von
verdünnter Schwefelsäure (H2SO4) statt. Die Schwefelsäure fungiert hier lediglich
als Katalysator.
Die Trimerisation liefert den bei Zimmertemperatur flüssigen Paraldehyd. Seine chemische Bezeichnung ist 2,4,6-Trimethyl-1,3,5-trioxan
Durch eine Reaktion von vier Molekülen entsteht der feste Metaldehyd. Anders als Paraldehyd bildet sich Metaldehyd aber nur in der Kälte; man muss deshalb das Reaktionsgemisch auf 0 °C abgekühlt halten.
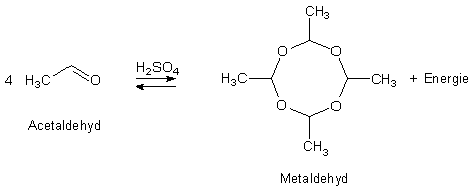
Im Metaldehyd kommen auch größere Ringe vor.
Die beiden Verbindungen haben, obwohl ihnen dieselben Bausteine zu Grunde liegen, unterschiedliche Anwendungsbereiche gefunden. Paraldehyd wird unter anderem in der Medizin als Schlafmittel verwendet. Metaldehyd hingegen findet seine Anwendung hauptsächlich als Trockenspiritus - und als Mittel gegen Schnecken.
Die Polymeren sind zur Aufbewahrung geeignete, potentielle Formen
der Aldehyde
Die Bildungsreaktionen der Aldehydpolymere sind chemische Gleichgewichte. Aus diesem Grunde
kann man aus Paraldehyd bzw. Metaldehyd durch Erwärmen in Gegenwart von Schwefelsäure leicht wieder
Acetaldehyd herstellen (-> Versuch).
Analoges gilt (wie wir gesehen haben) für die polymeren Formaldehyd-Arten. Allerdings muss man da von den Festsubstanzen ausgehen, die man auch ohne Schwefelsäurezusatz erhitzt.
Paraformaldehyd dient als Trockenspiritus. Jeder Camper kennt diese stechend riechenden Feuerchen, mit denen er seinen Kaffee zubereitet. Ein anderer Trockenspiritus ist unter der Bezeichnung "Esbit" bekannt. Bei ihm handelt es sich jedoch um ein Polymeres aus Formaldehyd und Ammoniak, um Hexamethylentetramin (Urotropin).
Zum Umgang mit gealterten Formalinlösungen
Formalin(lösung) ist eine etwa 30%ige wässrige Formaldehydlösung. Jeder hat so sein Problem damit…
Ein Lehrer schildert es so: „Unsere Formalinlösungen sind im Laufe der Zeit polymerisiert, so dass der
gelöste Anteil an Formaldehyd darin so gering geworden ist, dass eine Herstellung von Phenolharzen im
Reagenzglasversuch damit nicht mehr möglich ist. Der Versuch, den Paraformaldehyd unter Wärmeeinwirkung
(in wässriger Lösung) zu depolymerisieren, war wenig erfolgreich. Kann man den Formaldehyd wieder freisetzen?“
Bei dem weißen Festkörper handelt es sich in erster Linie um Paraformaldehyd. Wir haben oben erfahren, dass dessen Bildungsreaktion bei 180-200 °C umkehrbar ist. Das geht aber nicht mit der wässrigen Lösung, denn da steigt die Temperatur immer nur auf etwa 100 °C. Der monomere Formaldehyd kann also nur zurückgewonnen werden, indem man die Festsubstanz abtrennt, trocknet und dann erhitzt.
Beim Versuch, Formaldehydlösung in Gegenwart von 2%iger Schwefelsäure zu erhitzen und so zu depolymerisieren, bildet sich das Trimere 1,3,5-Trioxan. Das ist ebenfalls eine farblose, kristalline Substanz.
Es bleibt somit leider nur eine Möglichkeit: Alte Formaldehydlösungen sollten am besten entsorgt werden.
Weitere Texte zum Thema „Aldehyde und Ketone“