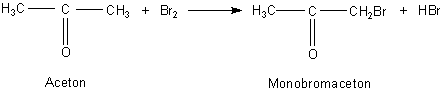
Reaktionen des Acetons
Aceton zeigt einige typische Reaktionen, die es in ihrer Gesamtheit ermöglichen, einmal projektartig an diesen Stoff heranzugehen. Hinzu kommen noch die Reaktionen, die zu seiner Bildung führen.
1. Reaktion mit sodaalkalischer Kaliumpermanganat-Lösung
Anders als mit den aliphatischen Aldehyden reagiert diese Mischung erst beim
Erwärmen. Das liegt daran, dass zur Reaktion das C-C-Gerüst des Acetons aufgebrochen
werden muss.
2. Reaktion mit Fehlingscher Lösung
Diese Reaktion verläuft anders als die mit Aldehyden negativ. Die Oxidationskraft
des Cu(II)-Ions reicht nicht aus zur Spaltung des C-C-Gerüsts des Acetons.
3. Legalsche Acetonprobe
Diese klassische Nachweisprobe funktioniert recht gut. Sie beruht auf einer
Umkomplexierung des Natrium-nitrosopentacyanoferrats(II).
Na2[Fe(II)(NO+)(CN-)5]
Offenbar wird das locker gebundene Nitrosyl-Kation NO+ gegen ein negativ geladenes Aceton-Anion ausgetauscht. Letzteres entsteht im alkalischen Milieu. Grund: Durch die benachbarte Carbonylgruppe werden die Wasserstoffatome der benachbarten CH3-Gruppen gelockert.
4. Iodoformprobe
Diese klassische Probe auf die Atom-Konstellation [CH3-CO-] funktioniert
schon in der Kälte. Deshalb beginnt die Iodoformbildung schon beim Mischen der Reagenzien.
Das Erwärmen ist oft gar nicht mehr notwendig.
Der Grund für die besondere Reaktivität liegt in der Aktivierung der CH3-Gruppen
durch die benachbarte Carbonylgruppe.
5. Bromierung von Aceton
Hierbei handelt es sich um eine elektrophile Substitution. Es bildet sich vor
allem Monobromaceton, das die Eigenschaften von Tränengas hat.
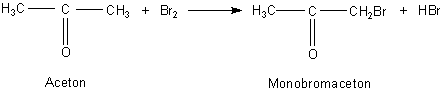
Der Grund für die Möglichkeit dieser Reaktion liegt in der benachbarten Carbonylgruppe. Durch sie werden die Wasserstoffatome der CH3-Gruppen gelockert, so dass hier ein Br+-Ion angreifen kann. Das substituierte Proton reagiert mit dem Br--Ion zu Bromwasserstoff.
6. Indigo-Synthese
Diese Reaktion kann auch als Nachweis für Aceton dienen.
Weitere Texte zum Thema „Aldehyde und Ketone“