Reaktionen 2. Ordnung und Reaktionen pseudo-1. Ordnung
Experimente:
Versuch: Reaktionskinetik der Entfärbung von Kristallviolett
Sind an der Reaktion zwei Edukte beteiligt, so gehen auch deren Konzentrationen in
die Reaktionsgeschwindigkeit ein. (Die mathematischen Gleichungen zeigen wir in
einer besonderen Webseite.)
Eine solche Reaktion 2. Ordnung kann heute in der Schule nicht mehr durchgerechnet werden, da die Integrationstechnik fehlt, wie hier die um 1960 noch in der Schulzeit des Autors viel genutzte Methode der Partialbruchzerlegung.

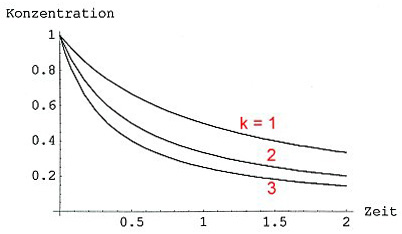
Konzentrations/Zeitkurven für Reaktionen 2. Ordnung des Typs 2 A -> B mit verschiedenen Werten von k
Glücklicherweise ist es nicht immer notwendig, den geballten mathematischen Hintergrund anzuwenden. Diese Probleme können nämlich durch Reduzierung der Reaktionsordnung umgangen werden. Viele Reaktionen 2. Ordnung lassen sich nämlich wegen des Überschusses eines Reaktionspartners in Reaktionen 1. Ordnung umwandeln. Man vermeidet so die aufwendigen Integrationen.
Übrigens muss es sich nicht immer um Überschüsse eines Reaktionspartners handeln. Das können auch Protonen oder Hydroxid-Ionen sein, die ständig durch Puffer ausreichender Kapazität nachgeliefert werden.
Ein Beispiel aus der Umweltchemie sind die OH-Radikale, die als Reinigungsmittel der Atmosphäre bei der Oxidation von Schadstoffen wie Kohlenstoffmonoxid zu CO2 mitwirken:
dcOH / dt = k · cOH · cCO
Je mehr davon in der Atmosphäre sind, desto schneller erfolgt der Abbau der Schadstoffe. Da der atmosphärische Gehalt an OH-Radikalen im Allgemeinen konstant ist, definiert man eine neue Geschwindigkeitskonstante:
k' = k · cOH
Man beschreibt deshalb die Umsatzrate von atmosphärischen Schadstoffen auch
direkt durch die Konzentration der OH-Radikale cOH. (Allerdings
nimmt momentan die OH-Konzentration stark ab und ist deswegen nicht mehr als konstant anzusehen.
Der Grund dafür ist die hohe Luftverschmutzung durch organisch-chemische
Substanzen wie Lösemittel oder nicht verbrannte Kohlenwasserstoffe in den Abgasen
von Motoren.)
In der Schule bietet sich als Beispiel die Entfärbung von Kristallviolett
unter verschiedenen Konzentrationen von OH--Ionen an.
Weitere Texte zum Thema „Reaktionskinetik“