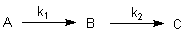
Folgereaktionen A -> B -> C
Von großer Wichtigkeit sind Folgereaktionen. Diese sind dadurch gekennzeichnet, dass sich ein Stoff A zunächst in B umwandelt, der seinerseits wieder in den dritten Stoff C übergeht. Inwieweit sich B anreichert, ist eine Frage der Geschwindigkeitskonstanten, genau gesagt ihres Verhältnisses.
Obwohl es für Folgereaktionen in der Chemie (vor allem in der Biochemie) viele Beispiele gibt, ist die bekannteste Anwendung der kinetischen Analyse von Folgereaktionen der radioaktive Zerfall. Hier sei an die Zerfallsketten der Uran-Isotopen bis zu denen vom stabilen Blei erinnert.
Die Geschwindigkeits- und die Konzentrations/Zeit-Gesetze
für Folgereaktionen
Hierzu betrachten wir eine formale Folge von zwei Reaktionen 1. Ordnung.
Die Entwicklung der Konzentrations/Zeit-Kurven ist relativ einfach und verlangt nur arithmetisches Geschick.
Wir gehen zur Vereinfachung davon aus, dass wir den Stoff A vorlegen; seine Konzentration beträgt zu Beginn a0.
A wandelt sich in einer monomolekularen Reaktion 1. Ordnung in B um. Das Geschwindigkeitsgesetz dafür ist
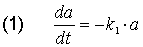
Bei dem Stoff B ist es komplizierter: B bildet sich aus A und wandelt sich gleichzeitig in C um. Die Geschwindigkeitsgleichung ist:
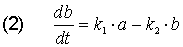
Die Geschwindigkeitsgleichung für C ist wieder einfach.
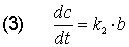
Nun besinnen wir uns darauf, dass zu jedem Zeitpunkt alle Konzentrationswerte zusammen a0 ergeben müssen.
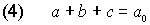
Die Integration der Gleichungen (1)-(3) ergibt unter Beachtung dieser Beziehung (4) die c/t-Gesetze für die drei beteiligten Stoffe A, B und C.
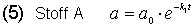
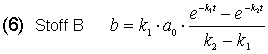
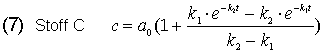
Stellt man diese c/t-Gesetze der drei Stoffe A, B und C in einem Diagramm dar, erhält man das folgende Bild.
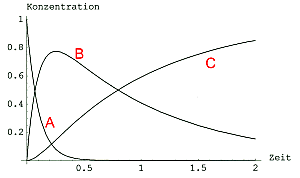
Bild 1: c/t-Kurven einer Folgereaktion mit k1 >> k2 ; k1 = 10, k2 = 1
Betrachten wir die Kurven in Bild 1:
Die Kurve für A folgt einer ganz normalen Reaktionskinetik 1. Ordnung.
Die Kurve für B dagegen durchläuft ein Maximum, weil B ja zunächst gebildet, dann
wieder abgebaut wird.
Die Kurve für C durchläuft eine Wendepunktskurve, bis sie bei a0 anlangt.
Das Reaktionsverhalten hängt vom Größenverhältnis der Reaktionskonstanten ab. Je
größer k1 im Vergleich zu k2 ist, desto mehr baut
sich vom Zwischenprodukt B auf.
Man vergleiche hierzu Bild 1 und 2.
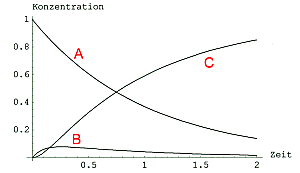
Bild 2: c/t-Kurven einer Folgereaktion mit k1 << k2 ; k1 = 1, k2 = 10
Der langsamste Schritt in einer Reaktionskette bestimmt die
Geschwindigkeit der Gesamtreaktion
Dieses Prinzip ist wichtig für alle Folgereaktionen, also auch für unsere
Stoffwechselprozesse. Bei denen handelt es sich um lange, teils sogar cyclische
Reaktionsketten, an deren durch eine kleine Geschwindigkeitskonstante
gekennzeichnete Engstellen autobahnartig Staus auftreten. Das ist für die
Regelbarkeit dieser Reaktionsketten von Bedeutung. Aber es führt auch zur
Ausbildung stationärer Zustände.
Die Einstellung stationärer Zustände bei Folgereaktionen
Stationäre Zustände beobachtet man, wenn eine zerfallende Substanz ständig
nachgeliefert wird oder die erste Substanz (wie das Uran-235) einer Reihe im
Vergleich zu den folgenden Substanzen sehr langsam zerfällt. So hat sich zum
Beispiel aus dem radioaktiven Zerfallsreihen von Uran ein Gleichgewichtszustand
(Radioaktives Gleichgewicht) ausgebildet,
der es gestattet, aus den heutigen Konzentrationen des betreffenden Isotops des
Endprodukts Blei die verstrichene Zeit zu berechnen (Altersbestimmung). Im Zusammenhang
mit dem radioaktiven Gleichgewicht stellen wir die Gesetzmäßigkeiten der Ausbildung der
stationären Zustände eingehender dar.
In der Biochemie nennt man den sich ausbildenden stationären Gleichgewichtszustand Fließgleichgewicht.
Stationäre Zustände von Folgereaktionen spielen auch in der technischen Chemie eine Rolle, zum Beispiel beim Betrieb eines Durchflussreaktors oder beim Hochofen.
Weitere Texte zum Thema „Reaktionskinetik“