Beispielhafte Herleitung einer Differentialgleichung für die
Reaktionsgeschwindigkeit
Experimente:
Versuch: Reaktionskinetik der Entfärbung von Kristallviolett
Wir wollen einen Reaktionstyp besprechen, anhand dessen man auch in der Schule
die Prinzipien der Reaktionskinetik gut zeigen kann. Die Reaktion schreiben wir nur
schematisch:
A + B ———> C + D
Ein Beispiel hierfür ist die Entfärbung von Kristallviolett durch OH--Ionen (-> Versuch). Aber auch Hydrolyse-Reaktionen gehören in diese Kategorie.
Die Reaktionsgeschwindigkeit ist für diesen Reaktionstyp:
dcA / dt = dcB / dt = - k · cA · cB mol/l sec-1
Wir schreiben das Minuszeichen, da die Stoffe A und B verschwinden, ihre Konzentration also abnimmt. Für das Entstehen der beiden Stoffe C und D gilt der positive Ansatz:
dcC / dt = dcD / dt = + k · cA · cB mol/l sec-1
Eines wird erfahrungsgemäß von Schülern stets gefragt:
Warum addiert man die Konzentrationen der beteiligten Substanzen nicht,
sondern multipliziert sie?
Chemische Reaktionen werden durch Stöße zwischen den Teilchen eingeleitet. Damit
hängt die Reaktionsgeschwindigkeit von der Stoß-Wahrscheinlichkeit ab. Hinter der
mathematischen Formulierung der Gleichungen für Reaktionsgeschwindigkeiten und
den Produkten der Konzentrationen der beteiligten Stoffe stecken deshalb
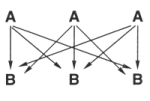
stochastische Überlegungen. So gibt es bei je drei Molekülen eines Stoffs A mit einem
anderen Stoff B nicht sechs, sondern neun zum Erfolg führende Stoßmöglichkeiten.
Diese zunächst rein theoretische Zahl berechnet man wie folgt: Nehmen wir an, es
handele sich jeweils um drei Teilchen A und drei Teilchen B (oder um eine Vielzahl
davon, z. B. jeweils drei Mol A und drei Mol B). Die Zahl der Treffer, die zu Reaktionen
führen können, ist 3 · 3 = 9. Das kann man anhand einer kleinen Graphik zeigen.

Zur stochastischen Behandlung der Stoßtreffer
Dass diese Annahmen stimmen, zeigt sich, dass die experimentell erhaltenen
Konzentrations/Zeit-Kurven tatsächlich diesem Mechanismus folgen.
Die Multiplikation der Konzentrationen macht Voraussagen für Laien wenig übersichtlich oder einsichtig, wie das Beispiel des stratosphärischen Ozonabbaus durch Chloratome zeigen kann. Man hat festgestellt, dass die Verdopplung der Konzentration der direkt beteiligten Chloratome nicht zur Verdopplung, sondern zur Vervierfachung der Geschwindigkeit des Ozonabbaus, also zu wesentlich rascherem Abbau als erwartet führt.
Aus der Geschichte
Der nachweislich erste Wissenschaftler, der die Zeitabhängigkeit chemischer Reaktionen
quantitativ im Sinne der Reaktionskinetik untersuchte, war der deutsche Chemiker Ludwig Wilhelmy.
Er erforschte die Spaltung von Saccharose durch Säure und formulierte zur Interpretation seiner
Ergebnisse die folgende, von ihm so formulierte Differentialgleichung:

(Poggendorff's Annalen, 81 (1850), 413, 499)
Weitere Texte zum Thema „Reaktionskinetik“