Recycling von Schwefelsäure und das Dünnsäureproblem
Experimente:
Erst das Wasser, dann die Schwefelsäure...
Im Zusammenhang mit der Schwefelsäure fällt häufig das Stichwort "Dünnsäure". Darunter
versteht man eine ca. 25%ige Schwefelsäure, die bei dem Phosphat-
und Titanataufschluss und anderen, vor allem organisch-chemischen Synthesen (z. B.
Veresterungen oder Nitrierungen)
anfällt und für die weitere technische Verwendung zu verdünnt und zu unrein geworden ist.
Man könnte meinen, dass - abgesehen von den Verunreinigungen - die Dünnsäure recycelt werden kann. Dazu ist Aufkonzentrierung notwendig. Schwefelsäure gibt allerdings wegen der stark exothermen Hydratbildung nur sehr schwer einmal aufgenommenes Wasser ab. (Deshalb ist sie ja gerade ein exzellentes Trocknungsmittel.) Hierzu sind sehr hohe Energien notwendig.
Recycling von Schwefelsäure?
Erst in neuester Zeit ist es gelungen, entsprechende wirtschaftliche Verfahren zu entwickeln.
Die Abfallschwefelsäure kann bei einem geringen Anteil an Verunreinigungen wieder aufkonzentriert und erneut eingesetzt werden.
Wenn man Schwefelsäurelösungen erhitzt, wird neben H2SO4 viel seines Anhydrids SO3 abgedampft. Andernfalls ist es möglich, die Säure bei 1000 °C thermisch zu spalten:
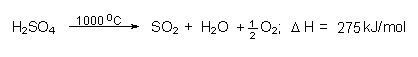
Das hierbei gebildete Schwefeldioxid wird im Kontaktverfahren wieder zu konzentrierter Schwefelsäure verarbeitet.
Alle diese Entsorgungsverfahren für Abfallschwefelsäure sind energieaufwendig und kostenintensiv. So ist die Herstellung reiner Schwefelsäure aus Abfallsäure etwa dreimal so teuer wie die Herstellung aus elementarem Schwefel. Deshalb wurden bisher erhebliche Mengen an Abfallsäure auf See verklappt.
Die Wirkung der im Meer verklappten Dünnsäure ist vielfältig
Einige Punkte sollen hier angesprochen werden.
Direkte, für Schwefelsäure typische Wirkung
| - | Wasserentziehung und Zerstörung organischen Materials. |
| - | Beim Verdünnen auch sog. "verdünnter" Schwefelsäure werden große
Wärmemengen frei. Dies senkt den Sauerstoffgehalt (Demand of oxygen; DO-Wert) der Einleitungs-Region.
Kleinlebewesen reagieren außerdem gegenüber den damit verbundenen Temperatursteigerungen sehr empfindlich. |
Saure Wirkung
Auch trotz Verdünnung verätzt die starke Schwefelsäure Kiemen und Schleimhäute und macht Meereslebewesen
empfindlich gegen Angriffe von Krankheitserregern (Bildung typischer Geschwüre bei Fischen).
Eisen(II)-Verbindungen (Grünsalz) in der Dünnsäure
| - | Eisen(II) wird durch Sauerstoff leicht zu Eisen(III) oxidiert. |
Fe2+ ———> Fe3+ + e-
O2 + 2 H2O + 4 e- ———> 4 OH-
| - | Dadurch wird dem Wasser Sauerstoff entzogen.
Im tierischen Gewebe ist darüber hinaus aufgrund der Einwirkung von Eisen(III)-Ionen Radikalbildung mit entsprechenden Folgeschäden möglich. |
| - | Eisenverbindungen setzen als sog. Kationen- oder aprotische Säuren bei der Reaktion mit Wasser Protonen frei und wirken zusätzlich versauernd; z. B.: |
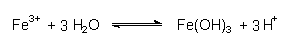
| - | Eisen(III)-Verbindungen sind nur in saurem Milieu löslich, bilden im neutralen Kiemenbereich aber flockige Niederschläge. Die Folgen sind Verstopfung bei gleichzeitiger Verätzung der Kiemen. |
Andere flockende Verbindungen
Für Titan- und Aluminiumsalze gilt das Analoge wie für Eisen(III)-Verbindungen. Sie sind
Kationensäuren und bilden ebenfalls flockige Niederschläge.
Schwermetalle
Diese gelangen besonders beim Aufschluss von Phosphaten in die Dünnsäure. Man beobachtet allgemeine
Vergiftungswirkung auf Nieren, Leber und Zentralnervensystem. Auch ist die Hemmung der Fortpflanzung
möglich. Besonders Cadmium ist hier zu nennen.
Senkung des Kohlendioxidgehaltes des Wassers
Stärkere Säuren wie die Schwefelsäure zersetzen Kohlensäure. Das Kohlendioxid entweicht. In der
Verklappungsregion finden deshalb kein Algenwachstum und keine Sauerstoffneubildung mehr statt. Die Folge
ist die Störung der Nahrungskette und zusätzlicher Sauerstoffmangel.
Gibt es Alternativen?
Denkbar sind schonende Synthese-Verfahren.
Weitere Texte zum Thema „Schwefel“