Schwefelwasserstoff - ein Überblick
Experimente:
Versuch: Herstellen von Schwefelwasserstoff aus FeS
Versuch: Herstellung von Schwefelwasserstoff aus Sulfidogen®
Versuch: Schwefelwasserstoff brennt
Versuch: Knallgas mit Schwefelwasserstoff
Versuch: Demonstration von Knallgas
Versuch: Schwefelwasserstoff ist eine Säure
Versuch: Bunte Reihe der Sulfide im Labor
Jeder kennt den Geruch von faulen Eiern. So riecht Schwefelwasserstoff,
der bei der Zersetzung schwefelhaltiger Eiweißstoffe entsteht. Schwefelwasserstoff ist auch ein
Bestandteil der Darmgase und der Atemluft, von Deponiegas und Biogas. Aber auch Erdgas kann
davon viel enthalten. Einige russische oder französische Erdgasarten enthalten sehr viel davon.
Der Geruch ist so charakteristisch, dass der schon als Nachweis für das Vorliegen der Substanz gilt.
Die chemische Formel von Schwefelwasserstoff ist H2S.
Gleich eine Warnung:
Schwefelwasserstoff ist giftiger als Blausäure. Nur, weil er so unangenehm riecht,
kommt es relativ selten zu Vergiftungen. Meistens sind das die Klärgrubenunfälle oder Unfälle in
Biogas-Anlagen. Besonders gefährlich ist Schwefelwasserstoff in großen Konzentrationen. Dann wird
er nämlich nach kurzem, anfänglichem Warngeruch geruchlos, weil er die Geruchsnerven "lähmt".
Im Labor wird Schwefelwasserstoff folgendermaßen hergestellt:
- Durch Einwirkung von Salzsäure auf Eisensulfid FeS (-> Versuch).
FeS + 2 HCl ———> FeCl2 + H2S
- Durch Erhitzen einer Mischung aus Kieselgur, Schwefel und Paraffin (-> Versuch). Diese Mischung ist bekannt unter dem Namen Sulfidogen®.
Schwefelwasserstoff ist ein Gas. Er ist brennbar (-> Versuch). Dabei entstehen Wasser und das stechend riechende Schwefeldioxid.
2 H2S + 3 O2 ———> 2 H2O + 2 SO2 + Energie
Mit Luft bzw. mit Sauerstoff bildet er sogar Gemische, die wie Knallgas explodieren können.
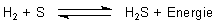
Wenn man die Flamme an einer kalten Oberfläche abschreckt, bildet sich Schwefel. Das liegt daran, dass der Schwefelwasserstoff (anders als Wasser) nicht sonderlich stabil ist. In der Hitze zerfällt er in seine Bestandteile. Die Synthese von H2S aus den Elementen und seine Zerfallsreaktion sind somit ein Beispiel für ein chemisches Gleichgewicht.

Der Grund für die geringe Stabilität von Schwefelwasserstoff liegt in seiner niedrigen Bildungsenergie. Während die Bildungsreaktion von Wasser aus seinen Elementen so stark exotherm ist, dass sie explosionsartig abläuft (Knallgasreaktion), ist die Energieentwicklung bei der Bildung von Schwefelwasserstoff aus seinen Elementen wesentlich geringer. Sie beträgt pro Mol H2X statt 286,0 kJ/Mol (beim Wasser) nur 20,6 kJ/Mol.
Das Gas reagiert mit Wasser vermischt wie eine Säure (-> Versuch). Es bildet deshalb auch Salze, die Sulfide (-> Versuch). Darunter finden sich wunderschöne Pigmente. In der Natur kommen viele dieser Sulfide als Mineralien vor. Auf der Sulfidbildung beruht auch sein Nachweis mit Bleiacetat-Papier (-> Versuch).
Bemerkenswert an Schwefelwasserstoff ist noch, dass seine Moleküle anders aufgebaut sind als die des homologen Wassers. Seine Moleküle haben kaum Dipol-Charakter. Deshalb ist Schwefelwasserstoff bei Zimmertemperatur nicht flüssig, sondern ein Gas. Hierzu haben wir eine besondere Webseite.
Weitere Texte zum Thema „Schwefel“