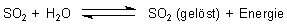
Eigenschaften der schwefligen Säure und der Sulfite
Experimente:
Versuch: Entwickeln von Schwefeldioxid aus Natriumdisulfit
Versuch: Bildung von schwefliger Säure
Versuch: Herstellen von schwefliger Säure
Versuch: Addition von Hydrogensulfit an Aldehyde
Versuch: Bleichung von Farbstoffen
Versuch: Bleichung von Blütenfarbstoffen
Versuch: Untersuchen von Trockenobst auf Schwefeldioxid
Versuch: Konservieren von Früchten mit Schwefeldioxid
Versuch: Chemie des Tintenkillers
Das Anhydrid der schwefligen Säure, das Schwefeldioxid SO2, löst sich nicht
allzu gut in Wasser.
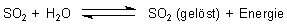
Dieses Gleichgewicht ist zunächst vom Druck und von der Temperatur abhängig.
In einer anschließenden Gleichgewichtsreaktion bildet das gelöste Gas instabile schweflige Säure.
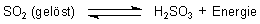
Dieses Gleichgewicht liegt fast ganz auf der linken Seite. Allerdings dissoziiert die Säure in zwei Stufen. Es bilden sich Hydrogensulfit und Sulfit.
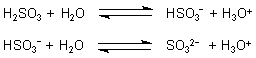
Man kann die Gleichgewichte verschieben, indem man den pH-Wert der Lösung verändert. Ansäuern führt zur Freisetzung von SO2, alkalisches Milieu zur Bildung von Sulfiten. Das zeigt, dass alle vier Gleichgewichte zusammenhängen. Das Ganze entspricht den Verhältnissen bei der Kohlensäure.
Alle Spezies des SO2/Wasser-Systems sind gute
Reduktionsmittel
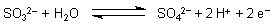
So wird Iod zu Iodid reduziert (Nachweisreaktion) oder Kaliumpermanganat zu Mangan(II)-Verbindungen.
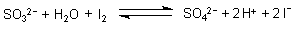
Die Molekülstruktur der schwefligen Säure und der Sulfite
Das Molekül der schwefligen Säure sowie das Sulfit-Ion haben aufgrund des freien Elektronenpaars
am Schwefelatom eine pyramidale Struktur.
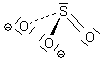
Bemerkenswert ist, dass es hinsichtlich der Bindung der Wasserstoffatome Alternativen gibt.
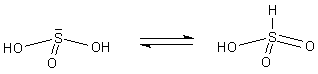
Dieser Wechsel der Bindungsstelle aufgrund wandernder Wasserstoffatome heißt Tautomerie. Das hat vor allem auch für die organische Chemie Bedeutung. Stoffe, die sich von der rechten tautomeren Form ableiten, heißen Sulfonsäuren R-SO3H. Bei ihnen sind das Schwefelatom und das Kohlenstoffatom des Rests direkt verbunden. Die von der linken Form abgeleiteten Substanzen sind dagegen Ester der schwefligen Säure: R-O-SO2H.
Schweflige Säure bildet auch eine dimere Säure
Die Dischweflige Säure hat die Formel H2S2O5. Man kann
sie sich als Additionsverbindung zwischen SO2 und H2SO3 vorstellen. Dabei sind
die beiden Schwefelatome verbunden - allerdings über eine anomal weite Bindung. Das erinnert an das
Dithionit.
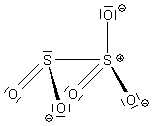
Ihre Salze sind die Disulfite (auch Bisulfite genannt) wie das Natriumbisulfit Na2S2O5. Unter Einwirkung von Säuren bildet sich daraus besonders viel SO2. Man nutzt Natriumbisulfit deswegen gerne im Labor zur Herstellung dieses Gases. Beim Lösen verhält es sich wie das Natriumhydrogensulfit:
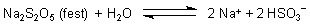
Deshalb werden beide Bezeichnungen synonym genutzt.
Schweflige Säure bildet Additionsverbindungen
Die schweflige Säure reagiert mit aktivierten ungesättigten organischen Verbindungen unter Addition.
Dabei bilden sich Sulfonsäuren. Bekannt ist die Addition an Triphenylmethanfarbstoffe (daher die Funktion von Hydrogensulfit als
Tintenkiller). Die Addition an Aldehyde war wichtig für die Kriegsindustrie (Stichwort:
Sulfitgärung).
Weitere Texte zum Thema „Schwefel“