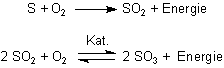
Die wichtigsten Oxide des Schwefels
Experimente:
Versuch: Verbrennen von Schwefel
Bei der Verbrennung von Schwefel (und von schwefelhaltigen Verbindungen) entsteht
zunächst Schwefeldioxid (SO2). Schwefeltrioxid (SO3)
entsteht nur bei Anwesenheit von Katalysatoren.
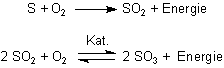
Schwefeldioxid ist ein farbloses, stechend riechendes und giftiges Gas, während Schwefeltrioxid ein fester farbloser Stoff ist, der schöne, lange, asbestartige Kristallnadeln bildet und in geschlossenen Behältern sogar sublimiert.
| Klick mich an! |
 |
| Sublimiertes Schwefeltrioxid
(Foto: Daggi) |
Lässt man die beiden Schwefeloxide mit Wasser reagieren, bilden sie in exothermer Reaktion Säuren.
Mit SO2 bildet sich in einer Gleichgewichtsreaktion die instabile Schweflige Säure.
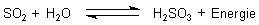
Mit SO3 entsteht die äußerst stabile Schwefelsäure.
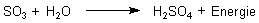
Diese Reaktionen sind Beispiele für die allgemeine Reaktionsgleichung
Nichtmetalloxid + Wasser ———> Säure + Energie
Die beiden Säuren dissoziieren und leiten den elektrischen Strom. Sie bilden jede als zweiprotonige Säuren zwei Reihen von Salzen.
Weitere Texte zum Thema „Schwefel“