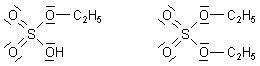
Schwefelsäureester
Schwefelsäureester bilden sich, wenn Schwefelsäure auf Alkohole einwirkt. Ihre allgemeine Formel ist R-O-SO3H. Da die Schwefelsäure über zwei OH-Gruppen verfügt, kann sie auch zwei Reihen Ester bilden:
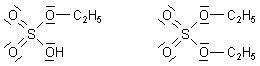
Man spricht bei den Estern auch von Sulfaten. Die Ester zwischen Ethanol und Schwefelsäure heißen Ethyl(hydrogen)sulfat bzw. Diethylsulfat. Der Monoester ist ein saures Sulfat und kann neutral reagierende Salze bilden.
Methyl- und Ethyl(di)sulfat gelten als Carcinogene bzw. Mutagene. Deshalb soll mit ihnen in der Schule nicht experimentiert werden. Da sie auch bei der klassischen, durch Schwefelsäure katalysierten Veresterungsreaktion gebildet werden, lohnt es sich, hierbei auf saure Ionenaustauscher als Protonenquelle zurückzugreifen (-> Webseite).
Schwefelsäureester bei der Herstellung von Ethen
oder von Diethylether
In der Schule ist die Herstellung von Ethen oder Ether aus Alkohol und Schwefelsäure bekannt.
Dabei bilden sich wahrscheinlich Schwefelsäureester als intermediäre Verbindungen. Dafür spricht
Folgendes:
| - | Ethen entsteht, wenn man Schwefelsäure im Überschuss zugibt und auf 180 °C erwärmt. |
| - | Diethylether bildet sich, wenn man Ethanol im Überschuss zugibt und höchstens auf 140 °C erwärmt. |
Schwefelsäureester von langkettigen Fettsäurealkoholen sind wichtige
Tenside
So ist z. B. das SDS (Sodium- bzw. Natriumdodecylsulfat) ein wichtiges Reinigungsmittel.
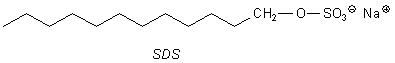
Man stellt es her, indem man den nachwachsenden Rohstoff
Palmitinsäure zum Alkohol reduziert und mit Sulfatierungsmitteln wie konzentrierter Schwefelsäure oder
Schwefeltrioxid umsetzt. Anschließend wird mit Natronlauge neutralisiert.
Diese Ester-Salze reagieren in Wasser neutral. Sie bilden außerdem anders als normale Seifen-Anionen
mit Ca- und Magnesium-Ionen keine schwerlöslichen Salze. SDS ist deshalb in Feinwaschmitteln wie z. B.
Fewa® enthalten. Mit ihm reinigt man auch gern empfindliche Laborgeräte - wie zum Beispiel Glaselektroden,
die man zu lange in fett- oder proteinhaltige Lösungen getaucht hat.
Viele Naturstoffe sind Schwefelsäureester
Dazu gehören die pflanzlichen Polysaccharide, zum Beispiel Carrageenane. Die bestehen
vor allem aus Galactoseresten und enthalten (wie auch viele andere, wasserbindende Polysaccharide) darüber
hinaus Sulfat- oder Carboxylatreste. Man nutzt sie in der Lebensmitteltechnologie als
Gelbildner.
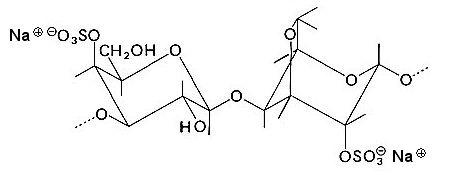
Struktureinheit von Carrageenan
Darüber hinaus gibt es noch mehr Substanzen: Schleimbildende Substanzen wie die Mucopolysaccharide,
zu denen letztlich auch das Chondroitinsulfat als wichtige knorpelbildende Substanz oder das
blutgerinnungshemmende Heparin (gebildet in Leber (lat. hepar; Leber) und in Leukozyten enthalten)
gehören. Klicke hier und lies Frage 1475.
Die biochemische Sulfatierung erfolgt im Allgemeinen ausgehend von anorganischen Sulfat-Ionen über das "aktive Sulfat", kurz PAPS.
Biochemische Schwefelsäure-Konjugate helfen beim Entgiften
Schwefelsäureester sind auch wichtig zur Ausscheidung von Fremdstoffen wie polykondensierte
aromatische Kohlenwasserstoffe (PAK). Hierbei koppelt das aktive Sulfat anstelle von Glucuronsäure oder
Glutathion (GSH) mit den enzymatisch intermediär gebildeten hochcancerogenen PAK-Epoxiden.
Als polare Gruppen macht der resultierende saure Schwefelsäureester PAK-O-SO3H bzw. sein Anion
PAK-O-SO3- diese "Konjugate" wasserlöslich und ausscheidbar. Vor allem werden auch Steroide
und Phenole auf diese Weise "entsorgt".
Weitere Texte zum Thema „Schwefel“