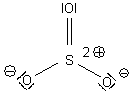
Die Molekülstruktur von Schwefeltrioxid
Mit drei Liganden muss das SO3-Molekül schon aus Gründen der optimalen Abstoßung der Sauerstoffatome bzw. der Elektronenpaare gewinkelt sein. Es ist tatsächlich von trigonaler, flächiger Symmetrie. Die O-S-O-Bindungswinkel betragen 360/3 = 120 °. Die Bindungslängen sind alle gleich. Das folgende Bild zeigt deshalb eine der möglichen mesomeren Grenzstrukturen.

Die Leser werden hier den Hinweis auf die Nichtgültigkeit der Oktettregel für die höheren Schwefelverbindungen vermissen. Diese Regel gilt immer noch. Die Theorie der Oktettaufweitung, die man lange Zeit benutzt hat, um die Strukturen zu erklären, ist mittlerweile überholt.
Die freien Orbitale des SO3-Moleküls haben eine interessante chemische Eigenschaft zur Folge: Schwefeltrioxid ist eine starke Lewis-Säure. So kann es zum Beispiel Lewis-Basen wie das O2--Ion oder ein H2O-Molekül addieren. Auf diese Weise entsteht das bekannte, tetraedrisch aufgebaute Sulfat-Ion.
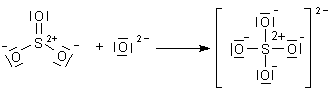
Man kann auch argumentieren, dass die drei Sauerstoffatome einen derartig hohen Elektronenzug auf das Schwefelatom ausüben, so dass es positiv polarisiert wird und für Liganden mit freien Elektronenpaaren zur Bindung bereit steht.
Deshalb können die SO3-Moleküle auch untereinander reagieren, wobei sie wechselseitig als Lewis-Säuren oder Lewis-Basen fungieren. Das kann man schematisch so zeichnen:
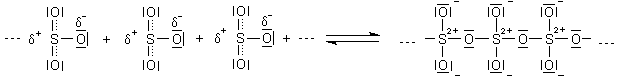
Aus diesem Grund gibt es die bislang besprochenen freien SO3-Moleküle nur im Dampfzustand, also oberhalb von 44,5 °C. Im festen Zustand liegen Trimere und sogar Ketten vor. Die sehen vereinfacht gezeichnet so aus:
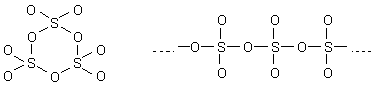
Die Kettenmoleküle bilden faserige, asbestartige Kristalle, die besonders schön durch Sublimation entstehen.
 |
 |
| Schwefeltrioxid und Asbest (Fotos: Daggi) |
Weitere Texte zum Thema „Schwefel“