Prof. Blumes Tipp des Monats Januar 2008 (Tipp-Nr. 127)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Naturwissenschaften an den Uracher Wasserfällen

Bild 1: Uracher Wasserfall
(Foto: Blume)
Die meisten Leute kennen nur einen einzigen Uracher Wasserfall. Der ist 37 Meter hoch. Verglichen mit dem höchsten Wasserfall der Erde (Salto Angel in Venezuela, 979 Meter) ist er wohl eher zierlich. Klein ist er zwar, aber fein. Denn an ihm kann man viel Chemie, Physik und Biologie lernen.
Aber wir dürfen nicht vergessen, dass es nur 1-2 Kilometer neben ihm noch einen Wasserfall gibt, den Gütersteiner Wasserfall. Der ist zwar viel kleiner, aber dafür umso schöner. Und viel interessanter. Denn bei ihm kann man viel mehr lernen. Vor allem sind hier die Effekte, wie er entsteht und was er bewirkt, viel deutlicher zu erkennen. Hinzu kommt, dass er – was die Besucherzahlen angeht - nicht so überlaufen ist wie der Original-Wasserfall. Das liegt wohl auch daran, dass er nicht so leicht zu erreichen ist. Nun aber zurück zum Original „Uracher Wasserfall“.
Aber warum schreibe ich diesen Tipp?
Mir wird aus der esoterischen Ecke immer wieder zugeraunt: „Wenn Wasser aus so einer Höhe stürzt,
bekommt es doch sicherlich Energie! Das merkt man, wenn man darunter steht. Also ist das Wasser
besonders gesund, denn damit führen wir unserem Körper natürliche Energie zu…“
Ist also Wasser, das wie der Uracher Wasserfall aus 37 Metern Höhe in die Tiefe stürzt, energiereicher als vor dem Fall? Lohnt es sich das zu trinken, weil es dann Energie in den Körper bringt? Kann man auf diese Weise Ausgaben für levitiertes Wasser sparen?
Es ist genau umgekehrt: Das Wasser hat beim Sturz einen Teil seiner Energie verloren. Wenn man unter einem Wasserfall steht, merkt man, was für Energiemengen beim Sturz in die Tiefe freigesetzt werden. Wasser ist ganz schön hart und kann entsprechend wehtun.
Ein Wasserfall wandelt die Energie des Wassers um
Die Tatsache ist jedoch: Es wird keine Energie freigesetzt, sondern es wird nur die Energie des Wassers
in andere Formen umgewandelt. Das sind unter anderem Energieumformungen, wie wir sie vom Zusammenstoß von
Autos her kennen. Einige der folgenden Energieformen kann man auch heranziehen, um das Wasser sinnvolle
Arbeit leisten zu lassen. Das kennen wir von den Wasserkraftwerken.
| 1. | Wasser hat zunächst eine potentielle Energie. Man sagt auch „Energie der (Höhen-)Lage“. |
| 2. | Wenn das Wasser den Hang herunterstürzt, wandelt sich ein Teil der potentiellen Energie in kinetische Energie („Energie der Bewegung“) um. |
| 3. | Ein Teil der kinetischen Energie wandelt sich in die Energie zur Deformation des Untergrunds um. |
| 4. | Beim Aufschlagen des Wassers auf dem Boden wandelt sich die Bewegungsenergie zum Teil in thermische Energie (Wärme) um. Das Wasser erwärmt sich deshalb etwas. |
| 5. | Ein Teil des Wassers verdampft: Das erfordert Verdampfungswärme. Die kühlt das Wasser wieder ab. |
| 6. | Als Chemiker dürfen wir auf keinen Fall die chemische Energie vergessen, also die Energie, die chemische Vorgänge begleitet. Weil im Wasserfall die meisten chemischen Reaktionen endotherm sind, werden diese durch Zufuhr von Reaktionsenergie erst ermöglicht. Viele chemische Reaktionen sind gehemmt und müssen erst „angestoßen“ werden (Aktivierungsenergie). |
Die chemischen Vorgänge im und um den Wasserfall
Zunächst einmal zwei Beobachtungen:
1. Das Wasser, das den Uracher Wasserfall speist, kommt sprichwörtlich aus dem Berg. Die Quelle entspringt unmittelbar am Fuße eines hohen, felsigen Steilhangs.

Bild 2: Quellpunkt des Wasserfallbachs (Brühlbach)
(Foto: Blume)
Diese Quelle wird gespeist durch Wasser, das auf der relativ flachen Albhöhe versickert. Das Gebirge ist von tiefen Spalten, Klüften und Höhlen („Kavernen“ oder „Dolinen“) durchzogen. Eine oberflächennahe und deshalb eingebrochene Doline kann man auf der Albwiese oberhalb des Wasserfalls bewundern. Wie ist die entstanden? Davon gleich mehr.
In den Höhlen und Spalten fließt das Wasser und versickert weiter – bis es letztlich auf eine Mergel- oder Tonschicht trifft, die „wasserdicht“ ist. Dann muss es sich einen anderen Weg suchen. Spielt sich das Ganze in der Nähe eines Berghangs ab, so entsteht eine Quelle.
Auf der Albhöhe wird intensive Landwirtschaft betrieben. Darüber, wie sich das Ausbringen von Gülle auf dieser porösen Albfläche vor allem bei Regenwetter auswirkt, kann man nur spekulieren. Aber eine Nitritbestimmung des Wasserfall-Wassers könnte sicherlich nicht schaden.

Bild 3: Gülleausbringung auf der Albfläche oberhalb vom Wasserfall
(Foto: Blume)
2. Wo das Wasser des Wasserfalls aufschlägt, sind dicke Lagen eines weichen
Kalksteins entstanden. Man spricht von Kalksinter oder Kalktuffstein. (Der Begriff
„Tuff“ stammt vom italienischen tufo oder dem lateinischen tofus und steht für einen weichen Stein aus
vulkanischer Asche.)

Bild 4: Kalktuff am Fuße des Wasserfalls
(Foto: Blume)
Was verbindet die Entstehung der Quelle und die Kalktuffsteinbildung?
Zusammenfassend kann man sagen:
| CO2 löst sich im Wasser. Etwas davon reagiert zu Kohlensäure. Diese
zersetzt den Kalk CaCO3 zu löslichem Calciumhydrogencarbonat (Ca(HCO3)2). So entstehen
die Löcher im Kalkstein.
Wird durch äußere Effekte dem Wasser das gelöste CO2 wieder entzogen, so werden auch die Kohlensäure und das Hydrogencarbonat zersetzt. Es bildet sich daraus weiteres CO2, das ebenfalls ausgast. Folglich bildet sich wieder Kalkstein - in Form von Kalktuff. |
Die gleichen chemischen Prozesse, wie wir sie eben für den Wasserfall beschrieben haben, sind übrigens auch die Ursache für das Entstehen von Tropfsteinhöhlen.
Nun aber etwas genauer zu den chemischen Hintergründen des Wasserfalls:
1 Die Quelle entsteht durch Kalkzersetzung
Das Quellwasser ist durch seinen Kontakt mit dem Kalkstein (CaCO3) gesättigt an den ionischen Bestandteilen,
die den Kalk aufbauen. Das sind folgende Ionen:
Calcium-, Hydrogencarbonat- und (relativ wenig) Carbonat-Ionen Ca2+, HCO3- und CO32- |
Anders gesagt: Das Wasser der Schwäbischen Alb ist auch im chemischen Sinne sehr
hart.
Die Ionen, die die Wasserhärte bedingen, werden auf folgende Weise gebildet: Das Regenwasser, das in den Stein einsickert, ist reich an atmosphärischem Kohlendioxid CO2. Dieses Gas löst sich im Wasser. Das schreiben wir schon einmal als Gleichung hin:

Ein geringer Teil des gelösten CO2 bildet Kohlensäure:
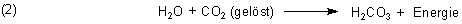
Diese Kohlensäure bildet als Säure Anionen, vor allem Hydrogencarbonat:
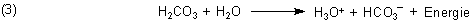
Kohlensäure löst den Kalkstein auf. Besser ist, wenn wir sagen, dass sie den Kalkstein zersetzt. Denn das ist ein echter chemischer Vorgang und kein physikalischer wie das Lösen. Hier ist die Reaktionsgleichung:
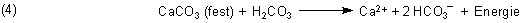
Diese Reaktion läuft in nennenswertem Umfang nur deshalb ab, weil Calciumhydrogencarbonat Ca(HCO3)2 in Wasser löslich ist. (Diese Eigenschaft kennen wir von entsprechenden Mineralwassern.) Wenn CO2-reiches Wasser einige Tausend Jahre auf den Untergrund einwirken kann, gibt es riesige Karsthöhlen – wie auf der Alb.
Klick mich an!
Bild 5: Marmorartiger Kalkstein mit Auswaschungen.
Das Bild von der Alb zeigt wohlgemerkt keinen Tuffstein!
(Foto: Blume)
Wir können das Zersetzen des Kalks im Experiment zeigen. Allerdings funktioniert das auf die Schnelle am besten, wenn man den Kalk vorher frisch fällt.
|
Versuch 1: Kalkzersetzung
Ca(OH)2 + CO2 ———> CaCO3 + H2O + Energie Leiten wir danach unter Rühren weiter CO2 ein, zersetzt sich der frisch gebildete Kalk-Niederschlag wieder. Wichtig: Die Zersetzung erfolgt erst, wenn das Wasser richtig (wenn auch nur schwach) sauer geworden ist! Prüfen Sie deshalb während der Reaktion den Verlauf des pH-Werts. |
2 Durch Wiederausfällung von Kalk bildet sich Kalktuffstein
Nun muss man bedenken, dass alle Reaktionen (1 - 4), die wir eben beschrieben haben, chemische
Gleichgewichte sind. Sie können, wenn chemisch verwertbare Energie zugeführt wird, auch in entgegengesetzter Richtung
verlaufen. Gleichgewichte steuert man nach Le Chatelier durch Änderung von Temperatur,
Druck und Konzentration.
Da ist zunächst die Erhöhung der Temperatur zu nennen. So kann man das CO2 regelrecht auskochen.
Weiterhin spielt der Druck eine Rolle, weil am chemischen Gleichgewicht ein Gas beteiligt ist: Wird der Druck erniedrigt, wird CO2 freigesetzt. Wir kennen das vom Öffnen einer Sprudelflasche, einer Champagnerflasche oder einer Flasche Bier.
All diese Veränderungen haben zur Folge, dass letztlich aus dem Wasser CO2 ausgetrieben wird, also seine Konzentration abnimmt.
Ähnliches beobachten wir beim Uracher Wasserfall. Alles in allem: Hier verlaufen die eben beschriebenen Reaktionen (1-4), die zur exothermen Zersetzung des Kalksteins führen, in entgegengesetzter Richtung ab. Wir führen diesmal Energie zu. Das führt deshalb zur endothermen Rückbildung von Kalkstein.
Dabei sind die Gründe vor allem für die Absenkung des Drucks erstaunlich: Das an gelöstem Calciumhydrogencarbonat und an gelöstem CO2 reiche Wasser fällt den Hang herab; dabei bilden sich Tropfen. Die fallenden Tropfen werden von Luft umströmt. Dadurch kommt es zu einer Druckminderung. Das besagt das Gesetz von Bernoulli. Die Folge ist, dass CO2 aus den Tropfen austritt. Man sagt: „Es gast aus.“
Außerdem werden die am Boden aufschlagenden Tropfen zerstäubt. Dadurch kommt es zu einer starken Oberflächenvergrößerung, die das Ausgasen noch fördert.
Nun zur Temperaturänderung: Dadurch, dass sich das Wasser beim Aufschlagen erwärmt, wird noch mehr CO2 aus dem Wasser ausgetrieben. Hinzu kommen jahreszeitliche Temperaturschwankungen des Wassers. Im Berg ist es konstant gleich temperiert, aber relativ kühl. Daher enthält das Wasser viel gelöstes CO2. Wenn es draußen wärmer ist, erwärmt sich das Wasser beim Austreten der Quelle. Das heißt: Noch mehr CO2 wird freigesetzt.
Betrachten wir nun die einzelnen Reaktionen. Da ist zunächst die Rückreaktion von Vorgang (1).
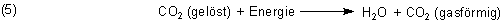
Das gilt auch für die Gleichung (2):
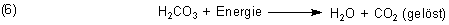
In Folge der Reaktion (6) geht dem Wasser langsam die Kalk zersetzende Kohlensäure aus. Deshalb muss dann auch die Reaktion (3) rückwärts laufen:
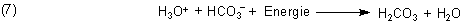
Nun wird auch das Hydrogencarbonat-Anion zur Mangelware, so dass sich letztlich der Kalkstein zurückbilden muss:
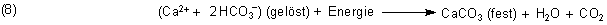
Der Kalk lagert sich unter und neben dem Wasserfall in dicken Tuffschichten ab.

Bild 6: Kalktuff neben dem Wasserfall
(Foto: Blume)
Hierzu kann man zu Hause eine Beobachtung machen:
|
Versuch 2: Kalkausscheidung aus Mineralwasser
Wir können den Sprudel auch erwärmen und so das CO2 austreiben.
|
Im ersten Versuchsteil ahmen wir in gewisser Weise die Verhältnisse im Wasserfall oder in Tropfsteinhöhlen nach. Dass schon beim Eingießen des Sprudels in die Gläser soviel CO2 frei wird, macht verständlich, dass dies auch beim Aufschlagen des Wassers auf dem Boden der Fall sein muss. Allein der Kontakt mit der Glaswand führt zur CO2-Freisetzung. Wie gewaltig muss diese Ausgasung beim Kontakt des Wasserfalls mit dem Boden sein?
Im zweiten Versuchsteil haben wir Mineralwasser erwärmt. So bilden sich die herrlichen Sinterterassen von Pamukale (in der Türkei) oder im Yellowstone-Park (Californien): Sie entstehen im Zusammenhang mit heißen Quellen. Darauf verweist auch schon die Bezeichnung Kalksinter: Sintern setzt Erhitzen voraus.
Egal, ob Wasserfall, Tropfsteinhöhle oder heiße Quelle die Ursachen sind: Es bildet sich stets ein mehr oder weniger grober, poröser, weicher Kalktuff, der zunächst noch eine nicht unbeträchtliche Menge an festem, aber instabilem Calciumhydrogencarbonat enthält. Dieses Gestein altert noch, wobei es Wasser und CO2 an die Außenluft abgibt.
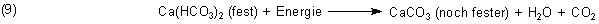
Der Kalktuffstein härtet deshalb erst mit der Zeit aus. Das ist auch der Grund, weshalb man frisch geschnittenen Kalktuff nicht sofort als Baustein verwenden kann, sondern noch lange Zeit (jahrelang!) offen lagern muss. Solche Lager waren früher im Hohenzollerngraben (Killertal) bei Hechingen zu sehen.

Bild 7: Aus Tuffstein erbautes Schulgebäude in Bad Urach
(Foto: Blume)
Auch Pflanzen sorgen für Kalktuffbildung
Am Fuße des Wasserfalls entnehmen Pflanzen dem kalkhaltigen Wasser für ihre Fotosynthese
Hydrogencarbonat-Ionen. Dieser Vorgang ähnelt letztlich dem in Gleichung (8).
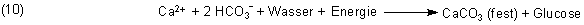
Das Wasser verarmt schließlich an CO2. Folglich fällt Kalktuff aus. Am Uracher Wasserfall übernehmen Pflanzen wie der Hirschzungenfarn die Rolle der Kalkbildner.

Bild 8: Hirschzungenfarn
(Foto: Blume)
Weil dem Wasser das Hydrogencarbonat direkt an der Oberfläche der fotosynthetisierenden Pflanze entzogen wird, bildet sich der Kalktuff gerade hier, so dass sich entsprechende Muster (Blattabdrücke und Stängelröhren) im Gestein bilden – wie das folgende Bild zeigt.

Bild 9: Biogenes Kalktuffgestein als römisches Baumaterial (Höhe des Bausteins: 30 cm)
(Anatolien/Türkei; Foto: Blume)
Dieser Stein heißt übrigens Spaghetti-Stein. Eigentlich müsste man ihn Makkaroni-Stein nennen… (Zum Unterschied von Spaghetti und Makkaroni gibt es die Anfrage Nr. 1478. Klicke hier.)
Dieser Vorgang ist für die CO2-Bilanz der Erde von größter Bedeutung. Damit wird der Atmosphäre CO2 entzogen; es wird als Bestandteil von Gesteinen abgelagert.
Aber nicht nur Pflanzen sorgen für die Verringerung des CO2 in der Atmosphäre. Hieran sind auch Tiere wie Häusle bauende Schnecken beteiligt. Die gibt es am Uracher Wasserfall in Mengen.
Wozu man Kalktuff verwendet
Kalktuff dient vor allem zum Hausbau, wie es im schon erwähnten Killertal bei Hechingen überall zu sehen ist.
Dazu kommt noch der diagenetisch (d. h. durch Einwirkung von Druck und/oder hoher Temperatur) veränderte Kalktuff, Travertin. Der Name stammt aus dem Lateinischen bzw. Italienischen und bezeichnet eine Gesteinsart aus der Umgebung der Stadt Tivoli (früher Tibur, daher lateinisch lapis tiburtius; aus dem ist dann durch allerlei sprachliche Verschiebungen das Wort „Travertin“ entstanden). Viele Leute kennen diesen Stein geschnitten und poliert als gelblichen, gebänderten Fußbodenbelag.

Bild 10: Travertin
(Foto: Blume)
Da er aus relativ weichem Kalkstein besteht, ist er mechanisch empfindlich, und es darf vor allem keine Säure darauf tropfen. Es reicht schon ein Glas Mineralwasser oder Zitronensprudel aus, um diesen Bodenbelag nachhaltig zu schädigen. Seine Porosität macht ihn darüber hinaus recht empfindlich gegenüber Verschmutzungen.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 20. Juli 2009, Dagmar Wiechoczek
