Prof. Blumes Tipp des Monats April 2006 (Tipp-Nr. 106)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Chemie mit dem Kirschlorbeer
Bald blüht er wieder in den Gärten und im Park, der immergrüne Kirschlorbeer (Prunus laurocerasus). Da sind zunächst seine schwer duftenden weißen Blütenstände und später die kirschartigen schwarzblauen Früchte, die von den Amseln komplett verschluckt werden.
 |
 |
| Bild 1: Kirschlorbeer (Fotos: Blume) |
Eine nette Lehrerin (bitte melden!) schrieb mir vor längerer Zeit, dass sie zur
Vorbereitung der Chromatographie von Pflanzenfarbstoffen
Blätter des Kirschlorbeerstrauchs zerreiben ließ. Dabei nahmen die Kinder den intensiven
Geruch nach Bittermandelöl wahr. Die Lehrerin schrieb sogar von Blausäuregeruch. Das
haben wir endlich einmal ausprobiert und bestätigt gefunden.
|
Versuch 1: Zerreiben von Kirschlorbeer-Blättern
|
Prinzipiell können es verschiedene Naturstoffe sein, die nach Bittermandelöl riechen: Einmal Benzaldehyd (bekannt als Aromastoff für Marzipan) und dann die Blausäure. Jawohl: Auch Blausäure ist ein Naturstoff!
Blausäure und ihre Salze (Cyanide) lassen sich mit der
Berliner Blau-Probe nachweisen
Diese aus der qualitativen organischen Analyse her bekannte Probe beruht darauf, dass
Cyanid-Ionen mit Eisen(II)-Ionen zunächst den äußerst stabilen Hexacyanoferrat(II)-Komplex
bilden.
Fe2+ + 6 CN- ———> [Fe(CN)6]4-
Dieser Komplex (auch aus dem Gelben Blutlaugensalz bekannt) reagiert mit Eisen(III)-Ionen weiter zum Berliner Blau.
Fe3+ + K4[Fe(CN)6] ———> K[FeIIFeIII(CN)6] + 3 K+
|
Versuch 2: Nachweis von Blausäure
|

Bild 2: Nachweis von Cyanid im Saft von Kirschlorbeerblättern (Foto: Daggi)
Links: Filtrierter Saft. Mitte: Nachweisreaktion.
Rechts: Frische Eisen(II)-sulfatlösung
Die weitere Analyse z. B. mit der HPLC, die wir in der
Schule allerdings nicht durchführen können, ergibt als weiteren Inhaltsstoff tatsächlich
Benzaldehyd. Diesen bei -56 °C schmelzenden Stoff kennt man auch unter der
Bezeichnung Bittermandelöl.
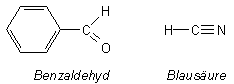
Wie kommt die Blausäure in den Kirschlorbeer?
Blätter und Früchte des Kirschlorbeer enthalten Glykoside. In diesem Fall
ist es vor allem das Prunasin.
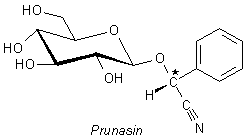
Wenn wir uns die Molekülstruktur genauer ansehen, stellen wir fest, dass das zentrale C-Atom asymmetrisch ist. Glykoside sind deshalb optisch aktiv; es gibt zwei Enantiomere. Das Spiegelbild-Isomere des Prunasins heißt Sambunigrin und ist das Gift des Holunders Sambucus nigra. Es ist aber auch im Kirschlorbeer enthalten.
In den Kernen des Kirschlorbeer finden wir auch einen dem Prunasin ähnlichen Stoff. Der ist auch in Bittermandeln (Prunus amygdalus) oder in Apfelkernen enthalten. Dieses Amygdalin unterscheidet sich kaum vom Prunasin. Es trägt statt nur eines Glucoserests zwei Glucosereste. Hier ist die Formel von Amygdalin.
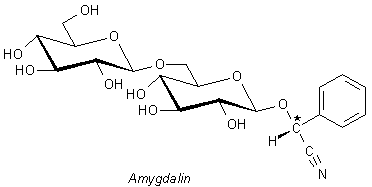
Glykoside sind die Ausgangsstoffe für Blausäure und
Benzaldehyd
Wir erkennen schon beim flüchtigen Hinsehen, dass die Moleküle der Glykoside einen Cyanid-Rest
enthalten. Dieser ist recht locker gebunden. Deshalb spricht man auch von cyanogenen
Glykosiden. 1000 g Bittermandeln setzen 3 g Blausäure frei! Mit fünf Bittermandeln sowie
mit etwa zehn Kernen der "Kirschen" vom Kirschlorbeer kann man ein Kind umbringen.
Hinter den cyanogenen Glykosiden steckt eine Verbindungsgruppe, die a-Hydroxynitrile (besser bekannt als Cyanhydrine). Diese bilden sich in einer Gleichgewichtsreaktion mit Blausäure aus Aldehyden bzw. Ketonen.
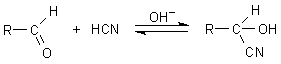
Bildungsreaktion der Cyanhydrine im Labor
Bei dieser Reaktion spielen OH--Ionen die Rolle von Katalysatoren.
Aufgrund der Gleichgewichtsreaktion sind Cyanhydrine nicht sonderlich stabil. Ein Teil von ihnen zerfällt spontan in die zugrunde liegende Carbonylverbindung und Blausäure. Bei diesem Zerfall wandert das Proton der Hydroxylgruppe zum C-Atom des Cyanidrests. Wenn aber kein Proton vorhanden ist, kann das Molekül auch nicht zerfallen. Und genau das macht die Pflanze: Sie bindet während der Synthese aus einer Aminosäurevorstufe (hier Phenylalanin) einen Zuckerrest an das O-Atom, und schon ist das letztlich entstehende Cyanhydrin stabil! (So etwas Ähnliches kennen wir auch vom Cumarin.)
Damit aber haben sich die Pflanzen ein Giftreservoir geschaffen, das hervorragend gegen Fressfeinde ("Herbivoren") wirkt. Blausäure wirkt auf alle aerob lebenden Organismen; es hemmt vor allem die Atmungskette, indem es mit den Eisen-Ionen der aktiven Zentren der Cytochrome reagiert. (Vergleiche Versuch 2!)
Wenn die Pflanze verletzt wird, spaltet sie zunächst enzymatisch den Zuckerrest ab. Das hydrolysierende Enzym nennt man Emulsin. (Der Name stammt daher, dass sich bei dieser Hydrolyse beim kräftigen Schütteln eine Emulsion bildet.) Dabei entsteht das freie Cyanhydrin ("Aglykon"), das dann Blausäure freisetzt. Dabei hilft auch ein Enzym (a-Hydroxylnitrilase) mit und beschleunigt den Vorgang.
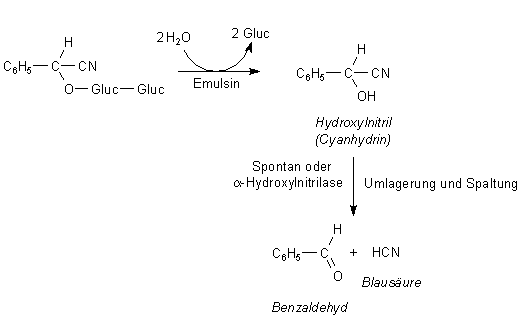
Warum produzieren die Pflanzen erst bei Verletzung
Blausäure?
Blausäure ist auch für Pflanzen giftig! Denn auch Pflanzen verfügen über die
Atmungskette und über Cytochrome. Intakte Pflanzen bunkern deshalb in ihren Zellen die Enzyme
und die cyanogenen Glykoside in verschiedenen Organellen. Erst wenn ein Blatt durch Pflanzenfresser
beschädigt worden ist, gelangen Substrate und Enzyme zusammen. Die chemische
Abwehrschlacht kann beginnen.
Wie erfolgreich diese Verteidigungsstrategie ist, zeigt sich schon daran, dass man über Tausend verschiedene Pflanzen kennt, die derlei Cyanogene enthalten. Der Bittermandelöl-Geruch der Blausäure ist für viele Fressfeinde ein deutliches Warnsignal. Sie meiden diese Pflanzen.
Wie giftig ist das alles?
Die cyanogenen Glykoside werden im Allgemeinen als giftig für Vögel, Insekten und Nager geschildert.
Das gilt auch für den Kirschlorbeer, wenn auch dessen Fruchtfleisch als weniger giftig gilt. Blätter und
Fruchtkerne dagegen werden als sehr giftig eingeschätzt.
Da habe ich so meine Zweifel, wenn ich sehe, wie die Vögel die Beeren zu Dutzenden fressen, ohne dass
sie vom Himmel fallen. Sie scheiden zwar die Kirschkerne wieder aus. Die fressen aber die Mäuse. Um an
das Innere zu gelangen, nagen die Mäuse kreisrunde Löcher in die hölzerne Hülle. Im Herbst finden wir
beim Abräumen unseres Holzstapels Hunderte von solchen Schalenresten, aber keine tote Maus.
Und wie ist das beim Menschen? Beim Erhitzen von bitteren Mandeln (zum Beispiel beim Backen des Weihnachtsstollens) wird Blausäure zwar freigesetzt, aber sie wird dabei als Gas ausgetrieben. Ein Teil wird wohl auch oxidiert und hydrolysiert.
HCN + ½ O2 + 2 H2O ———> NH4HCO3
Das letztlich entstehende Ammonium(hydrogen)carbonat ist ein alter Bekannter: Hirschhornsalz. Es ist als Treibmittel im Backpulver enthalten. Bei seinem Erhitzen entstehen nur Gase.
Die Cyanid-Ionen können aber auch direkt abgefangen werden. Es gibt (auch im Menschen) ein Enzym namens Rhodanase, das folgende Reaktion katalysiert:
CN- + S ———> SCN-
Der Schwefel stammt letztlich aus dem Abbau der Aminosäure Cystein. Das Rhodanid-Ion (bzw. Thiocyanat-Ion) ist bekannt aufgrund der Nachweisreaktion für Eisen(III)-Ionen.
In diesem Zusammenhang ist interessant, dass sich in Westafrika etwa 500 Millionen Menschen hauptsächlich von den Wurzeln und Blättern des Manioks (Manihot esculenta) ernähren. Dieses Wolfsmilchgewächs enthält reichlich Glykoside (vor allem Linamarin, das Cyanhydrin des Acetons). Die Menschen dort haben sich allerdings an diese Speise angepasst. Sie verfügen nämlich über besonders viel Rhodanase und überstehen so eine Tagesdosis von 35 mg Blausäure. Das ist die Hälfte der für normale Menschen letalen Dosis. Allerdings gibt es dort deutlich mehr Kropfbildungen als anderswo. Denn als so genanntes Pseudohalogen hemmt Rhodanid den Stoffwechsel des Iodids. Die Folge ist eine Schädigung der Schilddrüse.
Warum duften Blausäure und Benzaldehyd gleich, nämlich nach
Bittermandeln?
Diese Frage stellt sich oft. Vor allem zur Weihnachtszeit. Denn Bittermandelöl ist der Aromastoff
des Marzipans.
Übrigens riecht auch Nitrobenzol nach Bittermandeln. Deshalb hat man diese Substanz früher in Notzeiten
als Ersatzstoff für Bittermandelöl zur Herstellung von Marzipan benutzt. Bis man ihre Giftigkeit erkannte.
Vergleicht man die Strukturen der drei uns jetzt bekannten Substanzen, die nach Bittermandelöl riechen, so sind zumindest Benzaldehyd und Nitrobenzol strukturell einander so ähnlich, dass man erwarten kann, dass sie auch gleich duften.
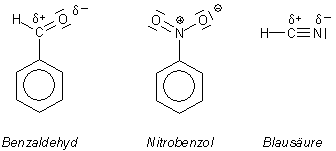
Dahinter steht die Theorie, dass unser Geruchssinn über weitgehend vorgefertigte Rezeptoren funktioniert, also nach einer Art Schlüssel-Schloss-Prinzip. Das erinnert ein wenig an die Immunabwehr durch Antikörper. Bei der Blausäure erkennt man das nicht auf dem ersten Blick. Vielleicht passt das HCN-Molekül aber ebenfalls in diese Rezeptoren hinein.
Lassen Sie mich ein wenig spekulieren: Möglicherweise ist das Erkennen von Mandelöl-Geruch im genetischen Gedächtnis der Fressfeinde von Pflanzen festgelegt. Denn wenn das eine da ist (Benzaldehyd), ist das andere nicht fern (Blausäure)... Die auf Benzaldehyd beruhenden cyanogenen Glykoside sind nämlich sehr weit verbreitet.
Allerdings duften nicht alle Carbonylkomponenten der cyanogenen Glykoside wie Bittermandelöl. Ein Beispiel ist das Aceton des Linamarins des Manioks. Da duftet nur die Blausäure nach Bittermandelöl.
Dumm ist nur, dass viele Menschen den Geruch gar nicht wahrnehmen. Sie sind sozusagen "geruchsblind" für Bittermandelöl und deshalb auch für Blausäure. Diese Menschen könnten ja durch den bitteren Geschmack der meisten cyanogenen Glykoside gewarnt werden. Leider gibt es auch viele "Bitterblinde". So verputzen manche Kinder ein Dutzend Bittermandeln; für sie schmecken die nur wie leckere Süßmandeln - Grund für viele Vergiftungen zur Weihnachtszeit, wenn zu Hause die Stollen gebacken werden.
"Bio" kann im realen Leben ganz schön gefährlich sein!
Rüdiger Blume
Literatur:
[1] J. B. Harborne: Ökologische Biochemie; Spektrum Verlag, Heidelberg 1995.
[2] H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie; Springer-Verlag, Berlin Heidelberg New York 2001.
[3] H. Beyer: Lehrbuch der Organischen Chemie, S. Hirzel Verlag, Leipzig (neueste Auflage).
[4] U. und M. Lochstampfer: Botanikus.de; CD-ROM "Pflanzen"; Langenhagen 2006; www.botanikus.de.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 09. Februar 2016, Fritz Meiners