Prof. Blumes Tipp des Monats April 2012 (Tipp-Nr. 178)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Knallgas und Kettenreaktionen
Früher hatten wir einen Chemielehrer, den wir echt gefürchtet haben. Nicht weil er so streng war - sondern weil er in fast jeder Stunde seinen Lieblingsversuch vorführte: Die Knallgasreaktion. Wir nannten ihn deshalb Hermann Bumm, den Knallgaschemiker.
Knallgas ist die Mischung aus Wasserstoff und Sauerstoff. Zur Demonstration füllt man meistens einen Ballon aber nur mit Wasserstoff und entzündet diesen. Der Ballon platzt, und die hinzutretende Luft sorgt für die Verbrennung des Wasserstoffs - es kommt zu einer Explosion. (Genau genommen ist das nur eine heftig verlaufende Verbrennung.)
Kenner setzten auf stöchiometrische Verhältnisse: Sie mischen die Gase im Volumenverhältnis 2:1 - wie es die Reaktionsgleichung vorschreibt.
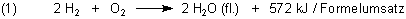
Die nunmehr echte Explosion und der damit verbundene Knall fallen wesentlich heftiger aus.
|
Versuch 1: Knallgasexplosion
Wir füllen einen vorgeweiteten Luftballon mit Wasserstoff und mit Sauerstoff. Den Ballon binden wir an einen Kartenständer.
Dann befestigen wir eine Kerze an einem langen Zeigestock, entzünden sie, setzen den Gehörschutz auf und berühren den Ballon
mit der Kerzenflamme.
|
Was läuft da ab, wenn die Knallgasmischung verbrennt?
Es handelt sich um eine Kettenreaktion, bei denen Radikale eine zentrale Rolle spielen.
Radikale sind besonders reaktionsfähige Teilchen mit einzelnen Elektronen.
Knallgasreaktionen beobachtet man erst, wenn man die Reaktionsmischung über 600 °C erhitzt. Das liegt daran, dass die Reaktionen eine hohe Aktivierungsenergie erfordern. Aus diesem Grunde sind Mischungen von Wasserstoff und Sauerstoff ungefährlich - solange man sie nicht erhitzt...
Beim Erhitzen der Knallgasmischung werden zunächst Wasserstoffmoleküle gespalten. Es bilden sich Wasserstoffradikale.
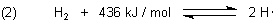
Nach diesem viel Energie verzehrenden Kettenstart reagieren die Wasserstoffradikale mit einem Sauerstoffatom unter Bildung von einem Hydroxylradikal (Hydroxyl) und einem Sauerstoffatom.
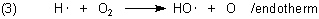
Ein weiteres Hydroxyl entsteht, wenn das O-Atom mit einem weiteren Wasserstoffmolekül reagiert:
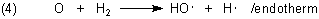
Die Hydroxylradikale reagieren mit einem Wasserstoffmolekül unter Wasserbildung.
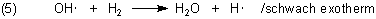
Da die Hydroxylradikale jeweils bei den Reaktionen (3) und (4) entstehen, muss man die Gleichung (5) in der folgenden Gesamtbilanz doppelt zählen.
Addiert man die Gleichungen (3), (4) und 2 · (5), so folgt für die Wasserbildung aus Wasserstoff und Sauerstoff die formale Gleichung (6).
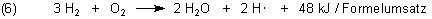
Bemerkenswert ist die mit (1) verglichene, geringe Energieausbeute. Man muss sich aber darüber klar sein, dass die meiste Energie des Systems noch in den H-Radikalen steckt. Wo die große Energiemenge der Knallgasreaktion herstammt, erklären wir weiter unten.
Den Zusammenhang zwischen den Reaktionen (3)-(5) kann man auch graphisch darstellen.
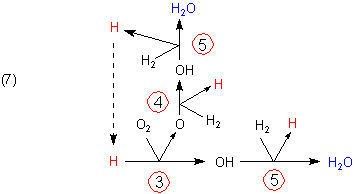
Verglichen mit Gleichung (6) scheint in Bild (7) ein H-Atom zu viel vorzukommen. Dieses geht aber über die Reaktion (3) zurück in den Reaktionszyklus.
Man kann durchaus von einem katalytischen Kreisprozess sprechen. Katalysator sind die H-Radikale. Da sich die Katalysatoren erst während der Reaktion bilden, ist dies auch ein Beispiel für eine Autokatalyse.
Gleichung (6) entnehmen wir: Für jedes gebildete Wassermolekül entsteht ein H-Radikal. Diese sorgen dafür, dass die Reaktion weiterläuft. Man nennt sie deshalb Kettenträger.
Es baut sich eine Kettenreaktion auf. Dabei werden die Reaktionen (3)-(5) immer wieder durchlaufen. Da dabei zwangsläufig immer mehr Wasserstoffradikale entstehen, handelt es sich somit um eine verzweigte Kette, die einen lawinenartigen Reaktionsablauf, also eine Explosion, zur Folge hat. Um das graphisch darzustellen, zeichnet man anstelle der H-Atome in Bild (7) jeweils wieder die gesamten Reaktionszyklen aus Bild (7).
Die Graphik (7) ist also quasi die Elementarreaktion der Reaktionskette. Dazu kommt noch die Startreaktion (2).
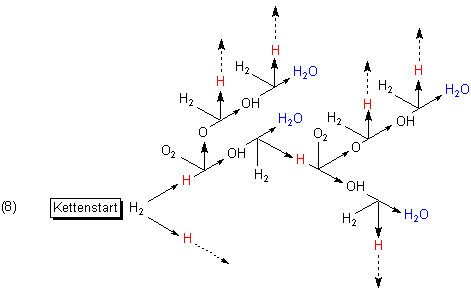
Irgendwann muss auch eine Kettenreaktion aufhören
Man spricht vom Kettenabbruch.
Das ist spätestens dann der Fall, wenn die reagierenden Gase aufgebraucht sind und sich die Reaktion mangels Reaktionspartnern totläuft.
Weiter können sich die Radikale gegenseitig selbst eliminieren. Aus zwei H-Atomen kann ein H2-Molekül zurückgebildet werden. Oder ein OH-Radikal und ein H-Radikal bilden ein H2O-Molekül. Dabei sind noch an der chemischen Reaktion selbst gar nicht beteiligte Moleküle notwendig, die als Stoßpartner einen Teil der Energie auffangen müssen. Das können zum Beispiel Stickstoffmoleküle sein.
Entsprechend können gasförmige Radikale ihre Energie auch durch Stöße an die Gefäßwände abbauen.
Es gibt aber noch andere Kettenabbruchreaktionen, die zu weniger reaktionsfähigen Stoffen führt. Beteiligt sind Radikale des Wasserstoffperoxids. Hier ist der erstaunliche Mechanismus:
Zunächst bildet sich das stabile und langlebige HO2-Radikal (Hydroperoxid).
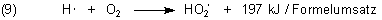
Zwei dieser ziemlich häufig auftretenden Radikale bilden nichtradikalische Substanzen, nämlich Wasserstoffperoxid und Sauerstoff.
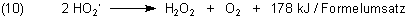
Addiert man Gleichungen (9) und (10), so erhält man eine formale Reaktionsgleichung (11). Dabei muss man die Gleichung (9) doppelt nehmen, da das Hydroperoxidradikal in Gleichung (10) zweimal vorkommt. Gleichung (11) macht deutlich, woher die weitaus größte Menge der Reaktionsenergie der Knallgasreaktion stammt.
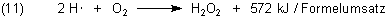
Bei diesen Reaktionen entsteht somit der größte Teil der Energie der Knallgasreaktion. Ursache ist der oben schon angesprochene große Energieinhalt der H-Radikale.
Die Energiemenge ist zwar genauso groß wie die Gesamtenergie der Knallgasreaktion (vergl. (1)), was aber eher Zufall und kein Hinweis darauf ist, dass die gesamte Energie der Knallgasreaktion ausschließlich bei dieser Reaktion entwickelt wird. Schließlich muss man noch an die hohen Aktivierungsenergien bei den Reaktionen (2)-(5) denken.
Mit dem Verlust an H-Radikalen ist die Kettenreaktion zwar an einzelnen Stellen abgebrochen. Wasserstoffperoxid kann aber mit den in der Reaktionsmischung immer noch im Überfluss vorhandenen H- und OH-Radikalen weiterreagieren, so dass seine aktuelle Konzentration stets gering bleibt. All das wirkt sich als Ausbremsen der Kettenreaktion aus, so dass sie schließlich insgesamt endet.
Knallgasreaktionen gibt es auch ohne Kettenreaktionen
Es ist wohl deutlich geworden, dass man eine durch Erhitzen ausgelöste Kettenreaktion kaum steuern kann. Das ist aber schade, weil
man irgendwie versuchen sollte, die Reaktionsenergie technisch nutzbar zu machen. Zur Steuerung muss man die Aktivierungsenergie deutlich
senken. Das macht man mit Katalysatoren. Am Besten gelingt das mit einem galvanischen
Element („Knallgaskette“). Die Elektroden spielen dort die Rolle von Katalysatoren. Erinnert sei an die Technologie der
Brennstoffzellen.
Es gibt noch weitere Kettenreaktionen
Ein bekanntes Beispiel ist die Reaktion zwischen Chlor und Wasserstoff (Chlorknallgas).
Weiter kann es auch zum Knall kommen, wenn man die Verbrennung von Ammoniak mit Sauerstoff demonstrieren will.
Außerdem sei an die Reaktion zwischen Schwefelwasserstoff und Sauerstoff erinnert, die man unter der Bezeichnung „Bellender Hund“ kennt.
Auch das Explodieren von Siliciumwasserstoff, wenn dieser mit der Luft in Berührung bekommt, ist hier einzuordnen.
Die ungesteuerte Reaktion von Methan mit Sauerstoff spielt eine Rolle, wenn es zu Unglücken mit Stadtgas kommt.
Die Krönung an Knallgasen ist die Mischung von Ethin und Sauerstoff. Da fallen schon einmal die Scheiben aus den Fenstern des Chemiesaals.
Erinnert sei auch an physikalische Kettenreaktionen aus der Kernphysik. Diese spielen in Kernreaktoren oder bei Kernwaffen eine Rolle.
Rüdiger Blume
Literatur:
A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie, Walter de Gruyter, Berlin, New York (neueste
Auflage).
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 01. April 2012, Dagmar Wiechoczek