Prof. Blumes Tipp des Monats Juni 2000 (Tipp-Nr. 36)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wenn Wasser beim Abkühlen kocht
Mit herzlichem Gruß an den Stöckhardt-Fan Prof. Dr. Günter Marx, Institut für Physikalische Chemie in der Naturwissenschaftlichen Fakultät der Technischen Universität in Chemnitz!
Mit dem Luftdruck lassen sich verblüffende Versuche machen. Ein schönes und vor
allem zur Diskussion anregendes Experiment schlägt der Chemie-Klassiker
J. A. Stöckhardt aus Chemnitz vor.
Hier ist seine Originalvorschrift von 1846 [1]:
"Ein halb mit Wasser gefülltes Kochfläschen wird so lange erhitzt, bis das
Wasser lebhaft kocht, dann vom Feuer genommen und schnell zugestöpselt; das Kochen wird
sogleich aufhören, dagegen wieder lebhaft beginnen, wenn man auf den oberen Teil des
Gefäßes kaltes Wasser gießt. Man kann es auf diese Weise selbst dann zum Wallen
und Kochen bringen, wenn es nur noch lauwarm ist."
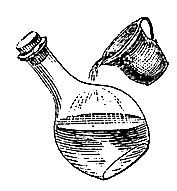
Bild 1: Original-Holzstich aus Stöckhardts Buch
Nun folgt die moderne Vorschrift, angereichert mit einigen Erfahrungen und Hinweisen.
| Klick mich an! |
 |
| Bild 3 (Fotos: Daggi) |
Stöckhardt erklärt die Angelegenheit selbst:
"In dem Gefäße ist keine Luft, denn diese wurde durch den Wasserdampf
ausgetrieben und konnte bei der Abkühlung und Verdichtung des letzteren nicht wieder
eindringen, da der Kork ihr den Weg versperrte. Das Wasser hat also über sich keinen
Luftdruck und dann kocht es schon bei einer Wärme von 20 °C. Der leere Raum im Glas
enthält nur Wasserdampf, und der lastet anfangs so schwer auf dem flüssigen Wasser,
dass das Kochen aufhört; wird er aber durch das aufgegossene kalte Wasser zu Theil
verdichtet, so vermindert sich sein Druck so sehr, dass wieder ein Theil Wasser unter
kochender Bewegung luftförmig werden kann."
Stöckhardt gibt auch gleich noch eine Belehrung dazu:
"In manchen Fabriken, z. B. in Zuckersiedereien, hat man eigene Apparate (Vacuumpfannen),
um Flüssigkeiten im luftleeren Raum zu kochen und zu verdampfen, namentlich solche, welche
durch stärkere Hitze leicht verschlechtert werden.
Die Luft ist am dichtesten in der Ebene und am Meere, sie wird umso dünner, je mehr
man sich von der Erde entfernt, weil man dann nur noch weniger Luft über sich hat. Es folgt
hieraus, dass auf einem Berge das Barometer niedriger stehen und das Wasser leichter kochen
muss als im Thale. Auf dem Gipfel des Montblanc steht das Quecksilber nur noch 16 Zoll im
Barometer und das Wasser gerät schon bei 84 °C in´s Kochen. Man kann daher sowohl das
Barometer als auch den Kochpunkt des Wassers dazu anwenden, um danach die Höhe der Berge,
welche sich besteigen lassen, zu berechnen."
(Ein Hinweis: Bei der Berechnung der Höhe muss man natürlich den durch die
Großwetterlage bedingten Luftdruck kennen und rechnerisch berücksichtigen.)
Für Interessierte haben wir eine Tabelle mit den
korrespondierenden Siedetemperaturen und Siededruckwerten des Wassers zusammengestellt. Ihr
könnt euch daraus eine Siedekurve (p-t-Diagramm) zeichnen. Die letzte Zeile der Tabelle
enthält übrigens die kritischen Daten für Wasserdampf.
Was lernen wir aus den Angaben von Stöckhardt bezüglich des
Montblanc?
Wir können endlich ausrechnen, wie lang ein sächsischer
Zoll in modernen Zentimetern ist.
Das Experiment als Schülerversuch
Der Lehrer Johannes Stoffels hat uns eine einfache und zugleich ungefährlichere Variante
von Versuch 1 geschickt, die den Versuch auch als Schülerexperiment durchführbar macht.
Eine weitere Demonstration der Wirkung des Vakuums
Wie immens stark die Außenluft auf das durch Abkühlen von Dampf evakuierte
Gefäß in Versuch 1 drückt, kann man auch mit einem weiteren, verblüffenden
Experiment verdeutlichen.
|
Versuch 2: Der platte Metallkanister
|
| Klick mich an! |
 |
| Bild 5 (Fotos: Daggi) |
|
Dieser Versuch lässt sich auch mit einer leeren Getränkedose durchführen. Dazu erwärmt man in der ausgetrunkenen Dose etwas Wasser über einer Kerze oder auf einer Herdplatte. Darauf achten, dass die Lackierung nicht ankokelt! Wenn das Wasser deutlich siedet (man kann es gut hören; stellt deshalb die Partymusik leiser!) und der Wasserdampf aus der Dose austritt, fasst ihr die Dose mit einem Handtuch oder Lappen und stülpt sie umgedreht, also mit der Öffnung nach unten, rasch auf kaltes Wasser. Dadurch kühlt das Wasser nicht nur den Doseninhalt, sondern verschließt auch die Öffnung. Augenblicklich implodiert die Dose. |
 |
| Bild 6 (Foto: Daggi)
Hierzu gibt es zwei Filme (-> Film 1 (1,9 MB)) und (-> Film 2 (1,2 MB)) |
Es wird deutlich, wie gering der Luftdruck in den Kochgefäßen bei
beiden Versuchen nach dem Abkühlen ist! Das kann man auch anhand der
Tabelle ausrechnen. Beträgt der Siededruck bei 100 °C 1,0133
bar, so sinkt er bei 20 °C auf 0,02337 bar. Die Druckdifferenz beträgt 0,9899 bar. Das reicht
aus, um den Metallkanister unter dem äußeren Luftdruck kollabieren zu lassen. Ein
fehlerhaftes Glasgefäß oder eines mit flachem Boden könnte deshalb in Versuch 1 eine
Katastrophe auslösen.
Zum Schluss: Kochen unter hohem Druck
Den umgekehrten Versuch, nämlich nachzuprüfen, ob Wasser unter vermehrtem Druck
schwerer siedet, sollte man wegen der Explosionsgefahr der Kochgefäße unterlassen. Es
muss ausreichen, bei erhöhtem Luftdruck, also einer Hochdruckwetterlage, Wasser zu
kochen und seine Siedetemperatur zu bestimmen. Die vergleicht man mit dem Siedepunkt bei
niedrigem Druck, also einer Tiefdruckwetterlage.
Das Kochen in verschlossenen Behältnissen wendet man sogar im Haushalt an: Viele
Familien haben einen Dampfdruckkochtopf. Dieser steht beim Sieden im Allgemeinen unter einem Druck
von 1,8 bar; das entspricht einer Siedetemperatur von 116 °C (Siehe Tabelle).
Bei höherem Druck öffnet sich ein Sicherheitsventil.
Rüdiger Blume und Heiner Schönemann
Literatur
[1] Ex libris Heiner Schönemann, Neukirchen-Vluyn:

Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. August 2008, Dagmar Wiechoczek

