Prof. Blumes Tipp des Monats Juli 2006 (Tipp-Nr. 109)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Alkohole sind keine Laugen. Ist Alkohol also eine Säure?
Betrachtet man die Struktur eines Alkohols, so könnte man meinen, dass es sich um eine Substanz handelt, die Hydroxid-Ionen bilden könnte.
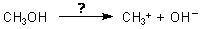
Ist Alkohol also eine Lauge?
Um das herauszufinden, untersuchen wir Lösungen von Alkoholen in Wasser.
|
Versuch 1: Wie reagieren Alkohollösungen?
Ergebnis:
Wir bestimmen die elektrische Leitfähigkeit der Lösungen. Ergebnis:
|
Wir stellen fest: Alkohole sind keine Laugen. Denn in wässriger Lösung dissoziiert kein OH--Ion ab. Wenn die Hydroxylgruppe abgespalten werden soll, so geht das nur unter Bildung von Radikalen.
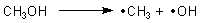
Und das ist nur unter starkem Aufwand an Wärme oder an Strahlungsenergie möglich.
Ist Alkohol eine Säure?
Wenn Alkohole Säuren wären, könnte man sich ja folgende Reaktion vorstellen:
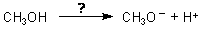
Bei der Messung des pH-Werts erhielten wir auch keinen Hinweis auf das Vorliegen einer Säure. Andererseits kann es sich ja beim Alkohol um eine derartig schwache Säure handeln, dass die Protonenkonzentration nicht zum Ansäuern der Lösung ausreicht.
Untersuchen wir deshalb andere typische Säurereaktionen.
|
Versuch 2: Reaktion zwischen Alkoholen und Natrium (Demonstrationsversuch)
Ergebnis:
Hinweis:
|
Offenbar ist folgende Reaktion abgelaufen:
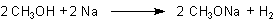
Die entstandene Substanz heißt Natriummethylat. Sie hat alle Eigenschaften eines Salzes.
|
Versuch 3: Untersuchung von Natriummethylat
Ergebnis:
|
Natriummethylat besteht wie ein Salz aus Ionen: Das Anion ist CH3O¯ und das Kation Na+. Dass das Salz kohlenstoffhaltig ist, erkennt man daran, dass es brennbar ist.
|
Versuch 4: Erhitzen von Natriummethylat
Ergebnis:
|
Nun kann man darüber spekulieren, ob dieses Verhalten des Alkohols dem einer klassischen Säure entspricht. Zu einer klassischen Säure gehört, dass sie in der Lage ist, in Wasser spontan Protonen abzuspalten. Diese Protonen werden von dem Metall reduziert.
Oxidation: 2 Na ———> 2 Na+ + 2 e¯
Reduktion: 2 H+ + 2 e¯ ———> H2
Das ist hier nicht der Fall. Alkohol hat keine dissoziablen H-Atome. Man darf deshalb die Reaktion zwischen Natrium und Alkohol ausschließlich als Reduktion des gesamten Alkoholmoleküls beschreiben:
Oxidation: 2 Na ———> 2 Na+ + 2 e¯
Reduktion: 2 CH3OH + 2 e¯ ———> 2 CH3O¯ + H2
Das Ergebnis ist:
Alkohole sind keine Säuren.
Hier hilft Brönsted weiter
Alkohole sollte man unter dem Gesichtspunkt des Brönstedschen Säure/Base-Konzepts betrachten. Das lautet
bekanntlich so:
Säuren sind Protonenspender, Basen sind Protonen-Akzeptoren.

Wir haben gesehen: Eine Säure kann der Alkohol (anders als das amphotere Wasser) nicht sein. Der Grund ist, dass die Methylgruppe "elektronenschiebend" wirkt, das heißt, sie übt einen (+I)-Effekt auf das Sauerstoffatom aus. Damit sinkt die Tendenz des Wasserstoffatoms, als Proton abzudissoziieren.
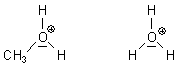
Wie die Struktur des Methanols verdeutlicht, besitzt es wie das Molekül des Wassers zwei freie, "nichtbindende" Elektronenpaare. Diese machen Alkohole zu einer Brönstedbase. Denn an diese nichtbindenden Elektronen können Protonen andocken. So reagiert Methanol tatsächlich mit Salzsäure bzw. mit Chlorwasserstoff zumindest teilweise wie folgt:
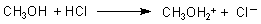
Das Ion entspricht dem Oxonium-Ion des Wassers: H3O+.
Wir lernen daraus:
Alkohole sind keine Säuren, sondern Basen.
Manche sagen, Alkohol sei amphoter
Man sollte demnach R-OH als Base und zugleich als (wenn auch äußerst schwache) Säure auffassen können:
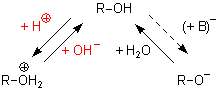
Die Base R-O- ist wesentlich stärker als die Base R-OH. Das Alkoholat-Anion bildet deshalb schon mit der Säure Wasser R-OH.
Alkohole sind Lewis-Basen
Auf die Alkohole lässt sich sogar auch modernste Säure/Base-Theorie anwenden. Zur Erinnerung: Nach G. N. Lewis
(1938) sind Säuren Elektronenakzeptoren, Basen Elektronendonatoren. Letztlich ist Komplexbildung nichts anderes als das
Produkt einer Säure/Base-Reaktion nach Lewis.
Alkohole gehören aufgrund ihrer nichtbindenden Elektronenpaare am Sauerstoff zu den Lewis-Basen. Das macht sie auch zu hervorragenden Komplexliganden. Darauf beruht auch der Nachweis der Alkohole mit Cer(IV)-ammonium-nitrat.
Wofür man Alkoholate benötigt
Diese Verbindungen sind wichtig für organische Synthesen. Sie sind nämlich starke Nukleophile. So könnte man sie
anstelle von Hydrogensulfit als Tintenkiller nehmen. Mit Wasser reagieren sie unter
Rückbildung des Alkohols und Bildung von Natronlauge:
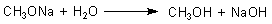
|
Versuch 5: Reaktion von Natriummethylat mit Wasser
Wir stellen anschließend eine neue, diesmal phenolphthaleinfreie Lösung her. Wir säuern mit Salpetersäure an (Überprüfen mit Universalindikator-Papier!). Mit Cerammonium-Reagenz versuchen wir, einen Alkohol nachzuweisen. Ergebnis:
|
Noch ein Hinweis
Die moderate Reaktion zwischen Natrium und Alkohol nutzt man im Labor, um Natriumreste zu vernichten. Früher hat
man das unter großem Hallo auf dem Platz vor dem Institut gemacht, indem man die Natriumabfälle einfach in Eimer
mit Wasser warf...
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 10. Februar 2010, Dagmar Wiechoczek