Prof. Blumes Tipp des Monats August 2008 (Tipp-Nr. 134)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Spielerei mit Stearin
Nicht nur um Weihnachten brennen überall Kerzen. Obwohl die meisten mittlerweile aus technischem Paraffin, einem Erdölprodukt, bestehen, gibt es auch noch Kerzen aus Stearin (griechisch: stéar; Talg, Fett). Dieses biogene Gemisch schmilzt bei 52-60 °C. Wenn die Schmelze weiter erhitzt wird, entwickelt sich ein Dampf, der entzündet werden kann. Das Verdampfen wird durch den Docht unterstützt. Hier haben wir Versuche zur Kerze.
Mit diesen Stearinkerzen kann man zu Hause ein hübsches Experiment machen.
|
Versuch: Der merkwürdige Stearinfleck
In eine hitzestabile Glasschale geben wir nicht zu wenig gut zerkleinerte Stücke einer Stearinkerze. Darauf füllen wir kochend-heißes Wasser. Damit die Mischung nicht so rasch auskühlt, decken wir die Schale mit einem Teller ab. Das Stearin schmilzt, ein Wachsfleck breitet sich auf der Oberfläche aus. Da er in viele kleine Tropfen, die wie Fettaugen aussehen, zerfällt, müssen wir ihn etwas zusammenschieben - z. B. mit einem Löffelstiel. Wir lassen das Ganze abkühlen.
Bild 1 (Foto: Blume) Hinweis: Wenn die Platte völlig einheitlich schmilzt, ohne Fettaugen zu bilden, so bestand die Kerze aus Paraffinwachs. In diesem Fall funktioniert der Versuch nicht! Andererseits bedeutet leider auch das Auftreten von Fettaugen nicht zwingend, dass es sich um Stearin handelt. Nach Festwerden des Stearins holen wir die Platte vorsichtig heraus. Sie ist erstaunlich stabil. Wir betrachten die Oberflächen und prüfen auch, wie sie sich anfühlen. Ergebnis (Bild 2):
Entsorgung:
|

Bild 2: Feuchte Stearinplatte von oben und von unten
(Fotos: Blume)
Das muss erklärt werden
Dazu brauchen wir Informationen über den Aufbau der Moleküle, die Stearin bilden.
Das ist ein Gemisch von festen Carbonsäuren. Im Allgemeinen enthält Stearin im Wesentlichen Stearinsäure
und Palmitinsäure. Da die Moleküle der Palmitinsäure fast genauso aussehen wie die der Stearinsäure,
beschränken wir uns hier auf letztere. Beide gehören zur Gruppe der gesättigten Carbonsäuren.
Palmitinsäure (Symbol: C16) hat zwei C-Atome weniger als die Stearinsäure (Symbol: C18).
Bild 3 zeigt ein Molekülmodell und die Strukturformel der Stearinsäure. Bei ersterem handelt es sich um ein Kalottenmodell, das die räumliche Anordnung der Atome und die Größenverhältnisse besonders gut wiedergibt.

Bild 3: Kalottenmodell, vereinfachte Strukturformel sowie ein Funktionsmodell der Stearinsäure
Die Moleküle dieser gesättigten Carbonsäuren sind merkwürdig aufgebaut. An einem Ende tragen die
Moleküle die Säuregruppe COOH. Diese nennt man auch Carboxyl-Gruppe. Man kann schon an
der Zusammensetzung erkennen, dass dieser Rest wasserfreundlich (hydrophil) sein muss.
So einen Molekülteil nennt man polar, weil in ihm Ladungen verschoben sind.
Am anderen Ende befindet sich ein anderer, viel längerer Molekülteil. Dieser erinnert an einen Kohlenwasserstoff; er heißt Alkyl-Rest (von Alkan; gesättigter Kohlenwasserstoff). Der ist wasserabweisend (hydrophob). Man sagt auch lipophil (fettfreundlich). So ein Molekülteil ist unpolar, weil sich in einem Alkan nur ganz geringe Ladungsverschiebungen einstellen.
Ein Molekül, das je einen polaren und einen unpolaren Rest trägt, hat die Eigenschaften eines (wenn auch schwachen) Emulgators. Deshalb haben wir im Versuch auch die Entstehung von „Fettaugen“ beobachten können.
Wenn die Stearinsäure auskristallisiert, lagern sich die stäbchenförmigen Moleküle nebeneinander so zusammen, dass alle hydrophilen und alle hydrophoben Enden jeweils in eine Richtung zeigen – also ganz anders, als sich etwa Stabmagneten ausrichten!
Hier ist das Modell für so eine Schicht.
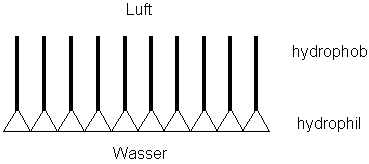
Bild 4: Einordnung der Stearinsäure-Moleküle
Wie kommt es zu dieser Anordnung?
Die hydrophilen Carboxyl-Reste hängen aufgrund der Wechselwirkung zwischen den stark polaren Resten zusammen. Man
spricht von Wasserstoffbrücken-Bindungen.
Die unpolaren Alkyl-Reste halten aufgrund von van der Waals-Bindungen zusammen. Deren Ursache liegt darin, dass sich die Elektronen um die Atome bewegen und es dadurch längs der Ketten zu einer feinen Ladungsunheitlichkeit kommt. Deshalb ziehen sich die Alkylreste (wenn auch nur ganz wenig) an.
Jetzt bleibt noch die Frage, was oben ist (also zur Luft zeigt) und was unten (also ins Wasser taucht). Warum sich die Moleküle ausgerechnet so ausrichten, wie im Versuch zu sehen war.
Wasser selbst ist stark polar, die Luft ist unpolar. Beim Kristallisieren der Stearinsäure ordnen sich die Moleküle so an, dass die hydrophilen Molekül-Enden Kontakt mit dem Wasser suchen und die hydrophoben Enden in die Luft zeigen. Das ist so wie mit den Entchen auf dem Teich: „Köpfchen in das Wasser, Schwänzchen in die Höh´“.

Bild 5 (Foto: Blume)
Ein Problem bleibt noch: Das Molekül der Stearinsäure ist äußerst klein. Es ist nur 2,45 nm oder 24,5 Ångström lang.
Ein nm (Nanometer) ist nur ein Milliardstel Meter! (Der Durchmesser eines Atoms beträgt übrigens 0,1 nm oder 1 Ångström.)
Die im Versuch erhaltene Schicht ist natürlich viel dicker als im Bild 4 gezeigt.
In der festen Stearinsäure ordnen sich die Moleküle schichtweise an. Zunächst bildet sich auf der Wasseroberfläche die „Startschicht“, wie im Bild 4 zu sehen ist. Darüber lagert sich eine zweite Schicht von Stearinsäure-Molekülen – aber diesmal mit den Alkyl-Resten nach unten. Beachten Sie, dass sich die gegenüberstehenden Alkylreste geringfügig überlappen. Nach oben ragen nun die Carboxyl-Gruppen. An diese lagert sich wieder eine Schicht Stearinsäure-Moleküle an, aber diesmal mit den Carboxyl-Gruppen nach unten.
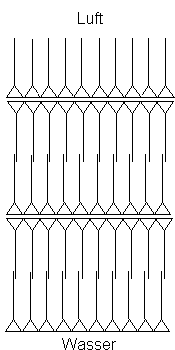
Bild 6: Schichtung der Stearinsäure-Moleküle
Und so geht es viele Tausend Mal weiter!
Genau genommen verläuft beim Abkühlen der Wasser/Stearinschmelze-Mischung der Kristallaufbau natürlich von unten her!
Zum Schluss entsteht insgesamt eine dicke Schicht, die auf der Wasserseite die polaren Carboxyl-Gruppen trägt und auf der zur Luft zeigenden Seite die Alkylreste. Auf der unteren Seite bindet sie Wasser und auf der anderen Seite lässt sie es abperlen - wie wir es im Versuch gesehen haben.
Hier werden wir mit einem genauso hochgeordneten Aufbau bekannt gemacht, wie wir es ja schon von Kristallen her kennen. Daraus lernen wir auch, dass Kristalle nicht immer hart sein müssen!
Wer es ganz genau wissen will:
Den Aufbau der Carbonsäurekristalle beschreiben wir im nächsten Tipp des Monats. Da erklären wir auch,
warum die (hinsichtlich der C-Atome) ungeradzahligen und geradzahligen Carbonsäuren so merkwürdig unterschiedliche
Schmelztemperaturen haben.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 10. Juni 2009, Dagmar Wiechoczek
