Prof. Blumes Tipp des Monats August 2015 (Tipp-Nr. 218)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Weshalb Salzsäure für Erdkundler unentbehrlich ist
Jedes Mal, wenn eine Gelände-Exkursion oder ein Wandertag anstand, kam ein Geographielehrer zu uns ins Institut und ließ sich ein Fläschchen mit konzentrierter Salzsäure auffüllen. Dazu packten wir ihm noch einige Tropfpipetten ein. Schließlich bat er noch um etwas Universalindikatorpapier. Wofür brauchte er die Sachen?
Der Lehrer war weniger Sozialkundler, wie es heute die meisten Erdkundelehrer zu sein scheinen. Er hingegen war noch ein echter Naturwissenschaftler. Deshalb war er auch in Geologie bewandert. Und er meinte, dass es nichts schaden könnte, bei einem Geländegang mit seinen Schülern auch etwas über den Boden, über den sie wanderten, zu erzählen. Zur Bodenkunde gehört natürlich etwas Wissen über die chemische Zusammensetzung.
Zur Einführung tropfte der Lehrer Salzsäure auf den Boden oder aufs Gestein. Wenn die Flüssigkeit unter Gasentwicklung aufbrauste, galt das als Hinweis auf Kalk.
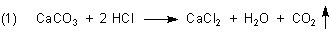
Blieb das Aufbrausen aus, so waren es eben Silicate. Wir haben dazu das Beispiel der Kieselsteine.
Um zu zeigen, dass Kalkstein aber kein reines Calciumcarbonat ist, packte der Lehrer einige saubere, weiße Steinchen (wie sie im Straßenschotter vorkommen) in ein Becherglas und übergoss auch diese mit Salzsäure. Die Steine zersetzten sich nicht vollständig. Zurück blieben fast immer bräunliche Flocken. Denn Kalkstein ist im Allgemeinen eine Mischung von Calciumcarbonat mit Tonmineralien. Letztere lösen sich nicht in Salzsäure. Man nennt diese Mischung Kalkmergel. Aus dem gewinnt man auch Zement.

Bild 1: Mergelhalde
(Foto: Blume)
Meistens wurde die Zersetzungsflüssigkeit deutlich gelb. Das zeigt das Vorliegen von Eisenverbindungen an - auch typisch für Kalkmergel. Die gelbe
Farbe entsteht aufgrund von Eisenkomplexen; zum Beispiel:

Das folgende Bild zeigt das Ergebnis des Versuchs.
Klick mich an!
Bild 2: Kalkstein und Salzsäure
(Foto: Blume)
Die Blasenbildung aufgrund der CO2-Freisetzung ist deutlich zu sehen. Die Blasen sind äußerst stabil und haben eine trübe Oberfläche; das kommt von
den Silicaten. Man erkennt auch gelbe Bereiche - Hinweis auf Eisen.
Und wozu benötigte der Lehrer das Indikatorpapier?
Damit prüfte er die Säure/Baseeigenschaften des Bodens. Dazu feuchtete er den Boden oder einen Kalkstein mit Leitungswasser gut an und legte feuchtes
Indikatorpapier darauf. Im Allgemeinen zeigt das Papier einen pH-Wert zwischen 8 und 9 an.

Bild 3: Indikatorpapier auf feuchtem Kalkstein
(Foto: Blume)
So konnte der Lehrer den Schülern zeigen, dass mergeliger Boden schwach alkalisch reagiert. Das liegt daran, dass das Carbonat und die Silicate Salze
von schwachen Säuren sind und unter Bildung von Hydroxid-Ionen hydrolysieren.

Mergel ist ein wichtiger Bodenbestandteil. Fehlt er, dann ist der Boden „ausgemergelt“. Deshalb muss ab und zu Mergel auf die Felder gestreut werden. Man spricht auch vom „Kalken“. Da Mergel alkalisch reagiert, kann man mit ihm auch saure Böden neutralisieren. Dabei hilft auch die säurebedingte Zersetzung des Kalks.
Wir lernen daraus:
Selbst im Geographieunterricht können einfachste chemische Feld-Experimente viel Spaß machen. Vor allem, weil auch die Schüler mitmachen können.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 29. Juli 2015, Dagmar Wiechoczek
