Prof. Blumes Tipp des Monats Oktober 2009 (Tipp-Nr. 148)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Quantitative Thermolyse von Silberoxid
Chemie kann Spaß machen, vor allem wenn man als Schüler selbst so richtig schön spielen kann, wenn’s bunt wird oder brennt, qualmt und knallt. Aber nur quantitative Versuche vermitteln den Aspekt, dass es sich bei der Chemie um eine exakte Wissenschaft handelt. Und wenn diese quantitativen Versuche dazu noch schön sind und auch die Auswertung nicht zu schwer ist, sollte das gelingen.
Ein solcher Versuch ist die Thermolyse von Silberoxid.
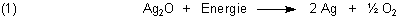
Silberoxid gibt es übrigens überall zu kaufen, z. B. auch bei Merck®. Es ist zwar nicht ganz
billig, aber man braucht ja auch nicht allzu viel für einen Versuch.
Zunächst zeigen wir den qualitativen Versuch, der durchaus auch für Schüler geeignet ist.
|
Versuch 1: Qualitative Thermolyse von Silberoxid
|

Links: Erhitzen von Silberoxid mit Glimmspanprobe.
Rechts: Silberoxid vor dem Erhitzen und danach
(Fotos: Daggi)
Nun wollen wir quantitativ an den Versuch herangehen
Das Besondere ist, dass wir das Ergebnis voraussagen können.
Zunächst rechnen wir die Stoffmengen aus, die zu erwarten sind. Das ist unter anderem auch deshalb wichtig, um die Gefäßgrößen und Einwaagemengen abschätzen zu können. Zur Berechnung benötigen wir die Molmassen der beteiligten Substanzen.

Das rechnen wir auf 1 g Silberoxid um.
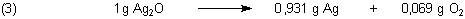
Um den Sauerstoffanteil zu ermitteln, könnten wir das Reagenzglas vor und nach dem Versuch wiegen.
Allerdings ist der Masseunterschied mit etwa 7 % so gering, dass sich Wiege- und andere Fehler stark
bemerkbar machen.
Wir gehen eleganter vor und nehmen als Messgröße das Volumen des entstandenen Gases.
Nehmen wir z. B. 1,30 g Silberoxid. Dann sollten wir nach Gl. (3) 0,069 g · 1,30 = 0,0898 g Sauerstoff erhalten. Die Stoffportion (Molzahl) des Sauerstoffs ist
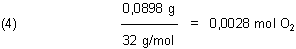
Anhand der Molzahl können wir mit Hilfe der Avogadroschen Zahl das Volumen des entstandenen
Sauerstoffs berechnen. Diese Avogadrosche Zahl ist von Druck und Temperatur abhängig. Bei t = 0 °C (273,13 K) und
Normaldruck beträgt sie 22413,8 ml/mol. Im Folgenden rechnen wir das Molvolumen für verschiedene
Temperaturen um. (Unsere Mess-Temperatur betrug im folgenden Versuch 22 °C.)
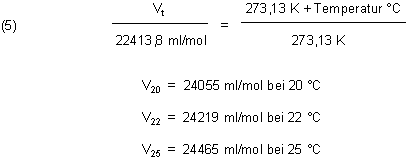
Auf die Druckkorrektur verzichten wir, da die Abweichungen nicht so bedeutend sind. Das zu erwartende
Volumen des Gases ist dann:
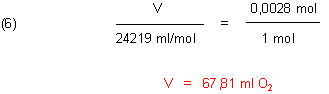
Unser quantitativer Versuch
Zuvor sind jedoch einige Hinweise notwendig. Als Temperatur zur Gasmessung wählt man diejenige des
Wasserbads, mit dem man das Gas „über Wasser“ auffängt.
Hinzu kommt, dass man das Silberoxid gut trocknen muss, aber natürlich nicht durch Erhitzen im Trockenschrank... Dazu nimmt man besser einen Exsikkator, in den man eine Schale mit KOH-Plätzchen oder mit konzentrierter Schwefelsäure stellt. Darin belässt man das Silberoxid ein paar Tage.
|
Versuch 2: Quantitative Thermolyse von Silberoxid
|
Wir sehen, dass das gefundene Ergebnis und der berechnete Wert recht gut übereinstimmen. Der Fehler beträgt nur 3 %:
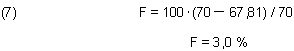
Chemie - wirklich eine exakte Wissenschaft?
Schüler meinen oft, dass die Chemie keine exakte Wissenschaft sein könne, wenn das Vorausgesagte nicht exakt einträfe.
Seltsamerweise erwarten auch viele Lehrer, dass alles zu 100 % richtig sein müsse, und sie äußern sich deshalb negativ zu
entsprechenden Versuchsvorschriften.
Schüler müssen lernen, dass eine exakte Wissenschaft eine Vielzahl von Vorschriften zur Voraussetzung hat, die es gewissenhaft zu erfüllen gilt. Da darf man zum Beispiel nicht mal schnell eine Vorschrift variieren, weil gerade statt der erforderlichen konzentrierten Schwefelsäure im Labor nur eine verdünnte zu finden war.
Man sollte immer mögliche Fehlerquellen ansprechen. Die sind im Fall der Thermolyse von Silberoxid, dass man in der für Schulzwecke vereinfachten Apparatur nicht überall die gleichen Temperaturbedingungen hat, dass sich etwas Sauerstoff in Wasser löst, andererseits aber auch Wasserdampf mitgerissen wurde - und so weiter. Außerdem haben wir keine Druckkorrektur vorgenommen. Vielleicht war das Silberoxid auch nicht genug getrocknet worden. Und so weiter...
Ein wichtiger Punkt ist auch die mangelnde Experimentierroutine. Die Schüler sind deshalb oft von ihren Ergebnissen enttäuscht. Wenn sie selbständig und ohne Anleitung arbeiten müssen, machen sie oft gravierende Fehler. Dabei meinen sie, dass alles beim ersten Mal klappen müsse. Ihnen muss vom Betreuenden der Facharbeiten deutlich gemacht werden, dass Experimentieren genauso eingeübt werden muss wie Radfahren, Schreiben, Scateboardfahren oder Musikmachen.
Ein Experiment muss auch in einer Facharbeit schon deshalb mehrfach wiederholt werden, um die Quellen für Fehler zu erkennen und so Fehler zu minimieren. Und es muss damit auch bewiesen werden, dass die Idee, die hinter dem Experiment steckt, richtig ist. Anders gesagt:
In einer exakten Wissenschaft muss jedes Experiment innerhalb gewisser Fehlergrenzen reproduzierbar sein.
Ist die Zersetzung von Silberoxid reversibel?
Nein. Das liegt daran, dass die Oxidationsenergie von Silber kleiner ist als die dazu notwendige Aktivierungsenergie, so
dass sich eher das Oxid zersetzt als bildet.
Um Silberoxid herzustellen, muss man deshalb einen Umweg beschreiten: Man stellt zunächst schwerlösliches Silberhydroxid her, das man dann vorsichtig entwässert.
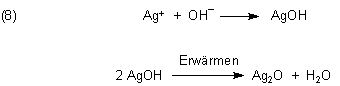
Hinweis
Es gibt noch einen anderen, in der Schule gern gemachten quantitativen Versuch, die Kupfersulfid-Synthese. Hierzu haben
wir eine besondere Webseite. Klicke hier.
Ein Aspekt, weshalb man Silberoxid im Labor haben sollte, muss noch erwähnt werden: Silberoxid kann das in der Schule immer noch genutzte, oftmals aus alten Beständen stammende Quecksilberoxid ersetzen. Klicke hier.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 29. September 2009, Dagmar Wiechoczek