Prof. Blumes Bildungsserver für Chemie
Tipp des Monats April 2017 (Tipp-Nr. 238)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Lässt sich die Stärke anorganischer Säuren voraussagen?
Uwe Lüttgens
Neulich sind wir im Unterricht über ein interessantes Problem gestolpert. Eine Schülerin fragte, woran man eigentlich erkennen kann, welche der beiden Säuren nun die stärkere ist – Salzsäure oder Schwefelsäure? Bild 1: Salzsäure und Schwefelsäure
Dahinter steckt die Frage, ob sich die Stärke von anorganischen Säuren eigentlich voraussagen lässt. Kann man die beiden Mineralsäuren – wir sprechen von Mineralsäuren, da sie sich aus Mineralien gewinnen lassen, deren Anionen in unserem Fall das Chlorid-Ion bzw. das Sulfat-Ion sind - überhaupt miteinander vergleichen? Oder ist es so wie mit den Äpfeln und Birnen, die sich ja bekanntermaßen auch nicht miteinander vergleichen lassen. Bild 2: Apfel und Birne
Ein wichtiges Basiskonzept: Das Donator-Akzeptor-Konzept
Damit du dich nicht verwirren lässt: In einigen Lehrbüchern findest du als Angabe den pKa-Wert, in anderen steht dort der pKs-Wert. Der einzige Unterschied besteht in der Sprache: Das tiefgestellte a steht für die lateinische acidum: Säure. Oder auch für die englische acid: Säure. Und der Index s natürlich für die Säure. Hier wird ein wichtiges Basiskonzept der Chemie angewendet, das wichtige Donator-Akzeptor-Konzept. Dieses findet nicht nur bei Säure-Base-Reaktionen, bei denen Wasserstoff-Ionen H+, also Protonen zwischen dem Donator (lat. donare spenden) und dem Akzeptor (lat. accipere annehmen) ausgetauscht werden, Anwendung, sondern auch bei Red-Ox-Reaktionen, bei denen zwischen dem Oxidationsmittel und dem Reduktionsmittel Elektronen ausgetauscht werden. Für Spezialisten: Die Protolysekonstante Ka und der Protolyseexponent pKa
Was können wir aus der Formel ablesen? Je höher die Konzentration an Hydronium-Ionen H3O+ ist – entsprechend steigt auch die Konzentration des Säurerest-Ions A- - desto größer ist der Wert für Ka. Wie wir aus der Reaktionsgleichung ablesen können, muss die Konzentration an Säurerest-Ionen genauso hoch sein, wie die der Hydronium-Ionen in der sauren Lösung: Hier taucht die Konzentration von H2O nicht mehr auf; sie wird als konstant angenommen, und zwar deshalb, weil sich durch die Reaktion der Säure die Konzentration von Wasser nicht merklich ändert. Der Wert für die Stoffmengenkonzentration in einem Liter Wasser ist übrigens c(H2O) = 55,6 mol/l, wie sich leicht berechnen lässt: oder in Kurzform: Setzt man nun die entsprechenden Werte für Wasser ein, ergibt sich für die Stoffmenge n an Wasser in einem Liter Wasser mit der Dichte 1: Die Werte für Ka sind ziemlich unhandlich. Entweder sind sie äußerst klein bei schwachen Säuren, die kaum dissoziiert sind. Oder aber sie sind extrem groß, wenn eine Säure mehr oder weniger vollständig dissoziiert vorliegt. Wie immer, wenn der Wert einer Größe über mehrere Zehnerpotenzen schwanken kann, nutzen Naturwissenschaftler gerne die Logarithmusfunktion. Dadurch, dass der Exponent einer Potenz genutzt wird, wird der Wert deutlich handlicher, nämlich in Form des negativen dekadischen Logarithmus, der als Protolyseexponent pKa oder auch einfach nur als pKa-Wert bezeichnet wird: Die geschweifte Klammer bringt zum Ausdruck, dass nur der Wert von Ka logarithmiert wird, dessen Einheit bleibt dabei unberücksichtigt, was mathematisch eigentlich nicht ganz sauber ist. Ein Logarithmus kann nämlich nur von dimensionslosen Zahlenwerten berechnet werden.

(Foto: Lüttgens)
(Foto: Lüttgens)
Nun, uns Chemikern fallen natürlich die tabellierten pKa- und pKb-Werte ein, die verlässlich über die Stärke von Säuren und Basen Auskunft geben: Je kleiner der pKa-Wert ist, desto stärker ist die Säure. Man könnte auch sagen, dass in einer sauren wässrigen Lösung die die Säure umso stärker dissoziiert (lat. dissociare spalten) vorliegt, je weiter rechts das entsprechende Säure-Base-Gleichgewicht liegt.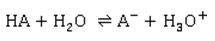
Die Grundlage für die Bewertung der Stärke einer Säure ist also die Lage des Gleichgewichts der Reaktion mit Wasser. Siehe z.B. unter [1] und auf dieser Website hier. Daraus ergibt sich die Protolysekonstante Ka: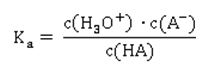
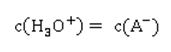
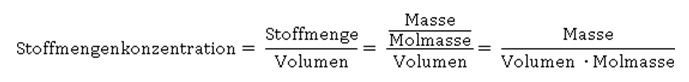
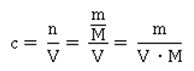
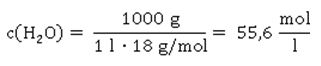
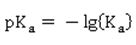
Säurestärke
pKa-Wert
sehr stark
≤ -1,74
stark
-1,74 ≤ pKa ≤ 4,5
schwach
4,5 ≤ pKa ≤ 9,5
Tabelle 1: Säurestärke und pKa-Wert
Und wie kommt man auf die Zahl -1,74? Dies ist der pKa-Wert der Säure H3O
Wer mehr erfahren will über die Dissoziation und Dissoziationsdiagramme, klickt hier.
Lässt die Struktur eines Säuremoleküls eine Voraussage der Säurestärke zu?
Zurück zu unserem Problem: Die Frage der Schülerin zielte genau darauf ab. [2, 3, 4] Schauen wir uns mal unsere Kenntnisse an: Die Überlegungen zum pKa-Wert besagen ja, dass ein Teil der Moleküle der Säure ihre Protonen an das Wassermolekül abgegeben hat. Die Bindung zwischen den H-Atom und dem benachbarten Atom – nennen wir es X – muss also heterolytisch gespalten worden sein. Das bindende Elektronenpaar verbleibt beim Atom X:
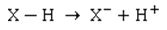
Die Frage ist also: Wie leicht lässt sich die X-H-Bindung spalten?
Dazu wollen wir unsere Kenntnisse über die polare Atombindung und das Konzept der Elektronegativität EN etwas auffrischen: Der Wert der Elektronnegativität hängt von der Atomgröße (Atomradius) und von der Kernladung ab. Rein qualitativ lässt sich eine „Je-Desto-Beziehung“ formulieren:
Je stärker einer der beiden Bindungspartner die bindenden Elektronenpaare in einer Atombindung anzieht, desto polarer ist die Bindung.
Der Wert für die Elektronegativität EN des „elektronenziehenden“ Atoms muss entsprechend größer sein als der des zweiten an der Bindung beteiligten Atoms. Je größer die Differenz der Elektronegativitäten der Atome ist, desto polarer ist eine Bindung. In der Regel spricht man ab einer Elektronegativitätsdifferenz von ΔEN = 1,7 von einer Ionenbindung.
Nun kommen der Atomradius und die positive Ladung des Atomkerns ins Spiel: Je kleiner der Radius eines Atoms ist, desto stärker ist die Anziehung eines Elektronpaars in einer Bindung. Anders gesagt: „Die Anziehung des äußeren Elektronenpaars nimmt ab, je weiter es vom Atomkern entfernt ist.“
Ebenso wird klar, dass eine hohe positive Kernladung zu einer Zunahme der Elektronegativität eines Atoms führen muss, wenn der Atomradius sich nicht zu stark ändert: „Je höher die Kernladung des Atoms (bei vergleichbarem Atomradius), desto größer ist die Anziehung des Elektronenpaars, also auch die Elektronegativität“.
1. Halogenwasserstoffsäuren
Helfen uns nun unsere Überlegungen weiter, um die Stärke der vier Halogenwasserstoffsäuren einordnen zu können? Welches ist die stärkste Säure - Flusssäure HF, Salzsäure HCl, Bromwasserstoffsäure HBr oder Iodwasserstoffsäure HI?
Dazu schauen wir uns die jeweiligen EN-Werte mal genauer an:
| Element | Atomradius in pm | Elektronegativität EN |
|---|---|---|
| H | 32 | 2,1 |
| F | 64 | 4,0 |
| Cl | 99 | 3,0 |
| Br | 114 | 2,8 |
| I | 133 | 2,5 |
Tabelle 2: Atomradius und Elektronegativitätswert
Nun schauen wir uns die pKa-Werte an:
| Säure | pKa-Wert |
|---|---|
| Flusssäure | 3,14 |
| Salzsäure | -7,0 |
| Bromwasserstoffsäure | -9,0 |
| Iodwasserstoffsäure | -11,0 |
Tabelle 3: pKa-Werte der Halogenwasserstoffsäuren
Der Tabelle können wir entnehmen: Die Iodwasserstoffsäure ist die stärkste Halogenwasserstoffsäure. Deutlich wird also, dass die X-H-Bindungslänge und damit der Radius des jeweiligen Halogenatoms bestimmt, wie stark eine Halogenwasserstoffsäure ist. Unsere Überlegungen könnten also lauten:
- Der Atomradius nimmt von Fluoratom über das Chlor- und Bromatom hin zum Iodatom deutlich zu.
- Die Bindungslänge X-H steigt entsprechend von F über Cl, Br zu I an.
- Das H+-Ion lässt sich zunehmend leichter ablösen, je länger und damit schwächer die Bindung ist.
- HI ist die stärkste Säure, HF die schwächste Säure.
Dies deckt sich mit den angegebenen pKa-Werten der Säuren. Jetzt lässt sich eine einfache Regel in Form einer Je-Desto-Beziehung formulieren:
Merksatz für Halogenwasserstoffsäuren:
Je größer der Bindungsabstand H-X (je schwächer also die Bindung), desto stärker ist die Halogenwasserstoffsäure.
Innerhalb einer Hauptgruppe lässt sich die einfache Regel an der Diskussion der Säurestärken von H2O, H2S, H2Se und H2Te überprüfen. Innerhalb einer Periode spielt die Polarität der Bindung die entscheidende Rolle. Hier müsste eine andere Je-Desto-Beziehung formuliert werden.
Merksatz innerhalb einer Periode:
Je polarer die Bindung H-X, je größer also die EN von X ist, desto stärker ist die Säure.
Dazu bietet sich der eindrucksvolle Vergleich von HF mit H2O und der Base NH3, an.
Angesprochen werden sollte noch die Rolle des Protonenakzeptors, der zu berücksichtigen ist, da die X-H-Bindung gebrochen werden muss, damit sich eine H-OH2-Bindung bildet. Hier taucht wieder das Donator-Akzeptor-Konzept auf!
2. Sauerstoffsäuren
Betrachten wir zuerst die Sauerstoffsäuren, die jeweils das gleiche Zentralatom – das ist das zentrale Atom in der LEWIS-Formel – besitzen.
Sauerstoffsäuren mit gleichem Zentralatom
Mit dem Schwefelatom als Zentralatom fallen uns gleich zwei Säuren ein: Die Schwefelsäure H2SO4 und die schweflige Säure H2SO3.
| Säure | pKa-Wert |
|---|---|
| Schweflige Säure | 1,81 |
| Schwefelsäure | -3,0 |
Tabelle 4: pKa-Werte der Schwefel-Sauerstoffsäuren
Wodurch unterscheiden sich die beiden Schwefel-Sauerstoffsäuren? Durch ihre Anzahl an Sauerstoffatomen, die am zentralen Schwefelatom gebunden sind. Jedes einzelne Sauerstoffatom zieht nun aufgrund seiner im Vergleich zu Schwefel (EN(S) = 2,5) höheren Elektronegativität von EN(O) = 3,5 in der polaren Bindung die Bindungselektronen deutlich an. Dies wirkt sich nun auch auf die beiden benachbarten O-H-Bindungen aus. Diese werden durch diesen elektronenziehenden induktiven Effekt – man spricht von einem –I-Effekt - geschwächt.
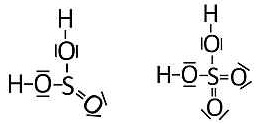
Bild 3: Strukturen von Schwefliger Säure und von Schwefelsäure
(Foto: Lüttgens)
Es macht nun einen deutlichen Unterschied, ob dieser Effekt von nur einer S-O-Doppelbindung oder von zwei S-O-Bindungen ausgeübt wird. Geht der –I-Effekt von zwei Sauerstoffatomen aus, dann werden die O-H-Bindungen deutlich schwächer. Anders gesagt: Die jeweiligen aciden Wasserstoffatome lassen sich leichter durch Wassermoleküle abspalten.
Wie lässt sich daraus eine einfache Regel formulieren? Betrachten wir die Oxidationszahlen, kurz OZ. Die Oxidationszahl des zentralen Schwefelatoms beträgt in der Schwefligen Säure H2SO3 + 4. Für die Schwefelsäure H2SO4 ergibt sich +6.
Merksatz für Sauerstoffsäuren mit gleichem Zentralatom:
Je höher die Anzahl an Sauerstoffatomen am Zentralatom ist, desto stärker ist die Säure.
Je größer die Oxidationszahl des Zentralatoms ist, desto stärker ist die Säure.
Sauerstoffsäuren mit unterschiedlichen Zentralatomen
Schauen wir uns zum Abschluss unserer Betrachtungen noch die Schwefelsäure im Vergleich zur Phosphorsäure an. Beide Sauerstoffsäuren besitzen am Zentralatom jeweils vier Sauerstoffatome. Schauen wir uns die pKa-Werte der ersten Dissoziationsstufe der beiden Säuren an:
| Säure | pKa-Wert |
|---|---|
| Phosphorsäure | 2,12 |
| Schwefelsäure | -3,0 |
Tabelle 5: pKa-Werte von Sauerstoffsäuren
Welcher strukturelle Unterschied ist für die deutlich verschiedenen pKa-Werte relevant? Vergleichen wir dazu die Elektronegativität: Sie ist für das zentrale Phosphoratom der Phosphorsäure mit EN(P) = 2,1 kleiner als die des zentralen Schwefelatoms der Schwefelsäure mit EN(S) = 2,5.
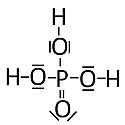
Bild 4: Struktur der Phosphorsäure
(Foto: Lüttgens)
Merksatz für Sauerstoffsäuren mit unterschiedlichen Zentralatomen:
Je größer die Elektronegativität des Zentralatoms (bei gleicher Anzahl an gebundenen Sauerstoffatomen), desto stärker ist die Säure.
Fazit
Die von meiner Schülerin aufgeworfene Frage nach der Möglichkeit zur Voraussage der Säurestärke bot anregenden Diskussionsstoff zur Bedeutung und zu den Grenzen einzelner Annahmen und Modelle. Wer sich in die Materie vertieft einarbeiten möchte, dem sei der Artikel von Holger Fleischer [5] empfohlen. Und sicherlich kann man sagen: Wir dürfen tatsächlich nicht Äpfel mit Birnen vergleichen.
Quellen:
[1] Chemie Oberstufe, Cornelsen Schulverlage, Berlin 2010, S. 158 ff.
[2] Chemical principles (3. Auflage) P. Atkins, L. Jones, W.H. Freeman, New York 2005, S. 379 ff.
[3] Chemie für die gymnasiale Oberstufe, Pearson, Hallbergmoos 2013, S. 457 ff.
[4] A. Nehring, N. Wegner, U. Lüttgens, Naturwissenschaftliches Arbeitsweisen fördern, in: Naturwissenschaften im Unterricht Chemie 158 (März 2017), S.24-29.
[5] H. Fleischer, Ist die polare Bindung notwendig für eine Säure? – Analyse einer verbreiteten Erklärung, in: CHEMKON 1/2022 S.13
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 25. März 2017, Fritz Meiners