Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Juni 2018 (Tipp-Nr. 252)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Tapetenkleister zum Titrieren?
Jens Schorn
Bild 1: Tapetenkleister beim Auftragen
Bei der letzten Renovierung waren wir doch zuerst sehr erschrocken, als wir den Tapetenkleister auf die extra weiß grundierte Wand aufgetragen haben. Anschließend sollte die weiße Strukturtapete auf die Wand geklebt werden. Bild 2: Tapetenkleisterverpackung
Ein Kleister für Vliestapeten mit dem Namenszusatz „Direct – control“ schien uns eine gute Wahl, doch beim Anrühren im schwarzen Eimer ergab sich schon eine rosa Färbung, die dann auf der Wand eher unpassend aussah. Bild 3: Tapetenkleister in Tüpfelplatte trocken (links) und mit Leitungswasser angerührt (rechts)
Bild 4: Verarbeitungshinweise auf der Verpackung
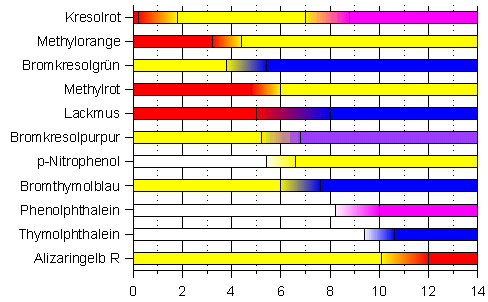
Damit man den Kleister auf die gesamte Wandfläche sichtbar auftragen kann, wird dem Produkt ein Farbstoff beigemischt, der beim Auflösen in Wasser zu einem pinken Kleister führt. So kann man beim Auftragen kontrollieren, an welchen Stellen man noch Kleister auftragen muss. Solche Stoffe bilden eine sogenannte alkalische Lösung und diese alkalische Eigenschaft zeigt sich beim Lösen des Natriumcarbonats in Wasser. Die hier entstehenden Hydroxid-Ionen (OH-) sind der Grund für die alkalische Eigenschaft des Tapetenkleisters. Es gibt hierzu sogar eine eigene Definition, die nach Herrn Arrhenius benannt ist. Stoffe, die beim Lösen in Wasser Hydroxid-Ionen bilden, nannte er Basen. Die Anwesenheit von Hydroxid-Ionen können wir nur mit Hilfe sogenannter Säure-Base-Farbindikatoren erkennen, denn die Hydroxid-Ionen reagieren mit den Protonen (H+-Ionen) des Indikators. Der Entzug der H+-Ionen führt bei dem Farbindikator zu einer Strukturveränderung und damit verbunden zu einer Farbänderung. Solche Farbindikatoren gibt es für die unterschiedlichen pH-Wertbereiche. Sie zeigen auf diese Weise ein bestimmtes Stoffmengenverhältnis von Hydroxid- und H+-Ionen in wässrigen Lösungen an. Bild 5: Farbindikatoren mit unterschiedlichen pH-Umschlagbereichen 0-14
Je nachdem welcher pH-Wert vorliegt, also wie groß die Konzentration an H+-Ionen ist, zeigen die unterschiedlichen Indikatoren eine bestimmte Farbe an. Hierbei fällt sofort auf, dass es nur wenige Indikatoren gibt, die bei einem Überschuss von Hydroxid-Ionen farbig, aber bei einem Überschuss an H+-Ionen farblos sind. Phenolphthalein und Thymolphthalein sind bekannte Beispiele. Experiment: Titration von Tapetenkleister mit Salzsäure Wer Genaueres über die Methode der Titration wissen möchte, der klicke hier: http://www.chemieunterricht.de/dc2/indikator/indi02.htm Man löst 1 g Tapetenkleister mit 250 ml destilliertem Wasser in einem Weithalserlenmeyerkolben.
Nun wird die Maßlösung langsam in die Probenlösung getropft und der pH-Wert gemessen. Bild 6: pH-Wertmessung von gelöstem Tapetenkleister
Beobachtungen:
Bild 7: Messung des Umschlagpunktes von Tapetenkleisterfarbstoff
Bei einem pH-Wert von 8,19 kommt es zu einer Entfärbung des Indikators im Tapetenkleister.

(Foto: Schorn)
Was ist mit dem Tapetenkleister geschehen?
Wie schon oft, haben wir beim Einkaufen von Kleister auf alt bekannte Produkte in der lila Verpackung zurückgegriffen.
(Foto: Schorn)
(Foto: Schorn)
Warum gibt es Tapetenkleister mit Auftragskontrolle?
Studiert man nun die Verarbeitungshinweise auf der Verpackung, so erklärt sich der Namenszusatz „Direct-control“.
(Foto: Schorn)
Warum entsteht der Farbton erst beim Lösen in Wasser?
Bei einem Blick in das Sicherheitsdatenblatt [1] zeigt sich, dass in dem Produkt Natriumcarbonat (Na2CO3) enthalten ist. Diesen Stoff kennt man auch unter dem Begriff Soda.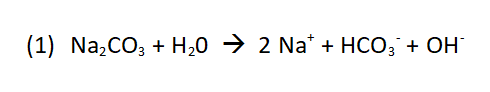
(Quelle: [2])
Welcher Farbindikator liegt im Tapetenkleister vor?
Zu dem Farbstoff, bzw. dem Indikator, werden auf der Verpackung und in dem Sicherheitsdatenblatt leider keine Angaben gemacht. Auch eine Nachfrage beim Hersteller ergab nur eine unklare Antwort.
Ein Vergleich der Farbigkeit der Lösung des Tapetenkleisters in Bild 6 mit der Übersicht in Bild 5 lässt sofort vermuten, dass hier in dem Tapetenkleister Phenolphthalein enthalten ist. Dieser Indikator ändert seine Farbigkeit bei einem pH-Wert zwischen 8,2-10,0 [3]. Er sollte also ab dem pH-Wert 8,2 farblos werden. Dies lässt sich einfach mit einer pH-Wertmessung bei laufender Titration feststellen.
Anschließend ergänzt man ein Rührwerk und einen Magnetrührfisch.
Eine herkömmliche Bürette (V = 50 mL) wird mit einer Maßlösung Salzsäure mit c = 0,1 mol/L gefüllt. Eine geeichte pH-Elektrode (Einstabmesskette) wird in die Probenlösung getaucht.
(Foto: Schorn)
Beim Start zeigt das pH-Meter einen Wert von 10 an.
(Foto: Schorn)
Es handelt sich also bei dem Farbstoff im Tapetenkleister um den Indikator Phenolphthalein.
Die Entfärbung findet deshalb statt, weil die H+-Ionen der hineingetropften Salzsäure die Hydroxid-Ionen des Tapetenkleisters (Probenlösung) durch folgende Reaktion neutralisieren.
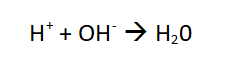
Somit liegen keine Hydroxid-Ionen mehr in der Lösung vor, die den Indikator ja zur Verfärbungen bringen.
Wie kommt es bei der eigentlichen Anwendung von Tapetenkleister wieder zur Entfärbung?
Verwendet man den Tapetenkleister, so zeigt sich ein gut sichtbares Pink an der Wand. Wie wir hier gesehen haben, verschwindet die Farbe nur, wenn der pH-Wert des Tapetenkleisters mindestens auf pH < 8,2 abgesenkt wird. In der gezeigten Titration haben wir Salzsäure verwendet, doch in der Praxis des Tapezierens besprüht man die Tapete ja nicht mit Salzsäure, sondern die Entfärbung findet von alleine statt. Dieser Prozess dauert aber einige Zeit.
Den Grund der Entfärbung findet man in der Luft bzw. in der Ausatemluft des Tapezierers.
Hierzu kann man ein einfaches Modellexperiment durchführen.
|
Experiment: Titration von Tapetenkleister mit Kohlensäure Man löst 0,5 g Tapetenkleister in 50 mL destilliertem Wasser und füllt diese Lösung in Reagenzgläser.
Bild 8: Einleitung von Kohlenstoffdioxid in Tapetenkleisterlösung
Ergebnis: Die Lösung entfärbt sich. |
Die Entfärbung findet mit Hilfe des Kohlendioxids aus der Luft statt. Das gasförmige Kohlenstoffdioxid wandelt sich mit Wasser zu Kohlensäure (H2CO3), Hydrogencarbonat-Ionen (HCO3-) und Carbonat-Ionen (CO32-) um.
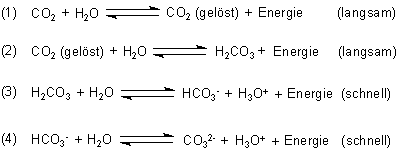
Bild 9: Gleichgewichtsreaktionen beim Einleiten von Kohlenstoffdioxid in Wasser [4]
Gerade in der Gleichung (3) sieht man, dass bei dieser Reaktion H3O+-Ionen oder einfacher gesagt H+-Ionen entstehen. Diese neutralisieren die im Tapetenkleister befindlichen Hydroxid-Ionen auf die gleiche Weise wie bei dem Titrationsexperiment mit Salzsäure. Dem Indikator werden zusätzlich H+-Ionen zugeführt. Er ändert seine Struktur und verliert seine Farbe und die Tapete klebt an der Wand, ohne dass die Farbe des Klebers zu sehen ist.
Wer noch tiefer in die Chemie des Phenolphthaleins einsteigen möchte, der wählt die Webseitengruppe dieser Homepage.
Welchen schulpraktischen Nutzen hat solch ein Tapetenkleister?
Für den Schulgebrauch ist die Verwendung von Phenolphthalein seit einiger Zeit nur noch eingeschränkt möglich. Zum Umgang mit der Toxizität gibt es ebenso in einschlägigen Richtlinien [5], wie auch auf dieser Homepage ausführliche Tipps und Hinweise. Empfohlen wird der Erwerb von 5%iger Fertiglösung, die man dann als Lehrkraft verdünnen soll.
Das folgende Experiment zeigt eine sinnvolle Alternative.
|
Experiment: Titration von Natriumcarbonatlösung mit Salzsäure mit Hilfe von „Direct-control“ Tapetenkleister 0,5 g Tapetenkleister „Direct-control“ werden in 50 mL destilliertem Wasser in einem Becherglas gelöst. Jeweils 2 mL Lösung werden auf drei Reagenzgläser verteilt.
Bild 10: gelöster Tapetenkleister vorbereitet zur Titration
Salzsäure mit c = 1 mol/L wird 1:10 verdünnt, sodass jeweils 10 mL Maßlösungen mit den Stoffmengenkonzentrationen c = 0,1 mol/L
Anschließend werden die Maßlösungen getrennt in die bereitgestellten Reagenzgläser titriert und jeweils der Verbrauch bis zur vollständigen Entfärbung notiert. Ergebnis:
Bild 11: Ergebnis der Titration
Verbrauchte Maßlösungen:
|
Die Verwendung von Tapetenkleister der Sorte „Direct-control“ bietet eine Möglichkeit einen „Laugelieferanten“ aus dem Alltag (Natriumcarbonat) direkt aus der Packung zu entnehmen und eine einfache Titration mit Salzsäure aus skalierten Tropf- oder Messpipetten vorzunehmen.
So beschränkt sich der apparative Aufwand und die Gefährdung durch Chemikalien und Geräte auf ein Minimum.
Quellen:
[1] Sicherheitsdatenblatt Metylan direct-control: http://www.i-m.de/gefahrstoffe/252815.pdf
[2] Bildquelle: http://www.chemieunterricht.de/dc2/indikator/images/iimg0201.gif
[3] Jander, Gerhart; Lehrbuch der analytischen und präparativen anorganischen Chemie; 13. Auflage; Stuttgart; 1989
[4] http://www.chemieunterricht.de/dc2/mwg/images/co2h2o.gif
[5] RICHTLINIE ZUR SICHERHEIT IM UNTERRICHT (RiSU) Empfehlung der Kultusministerkonferenz, Beschluss der KMK vom 09.09.1994 i. d. F. vom 26. Februar 2016. S. 81
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 31. Mai 2018, Fritz Meiners


