Prof. Blumes Bildungsserver für Chemie
Tipp des Monats November 2018 (Tipp-Nr. 257)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Hilft Eisen im Müsli gegen Eisenmangel im Blut?
Jens Schorn
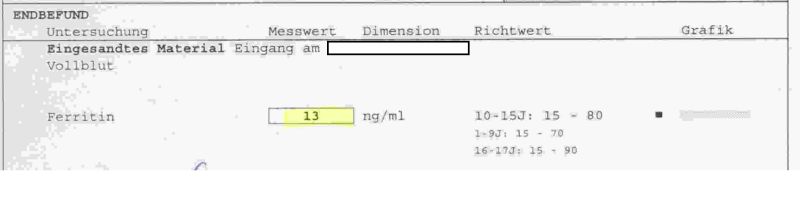
Bild 1: Ausschnitt aus einer Vollblutuntersuchung
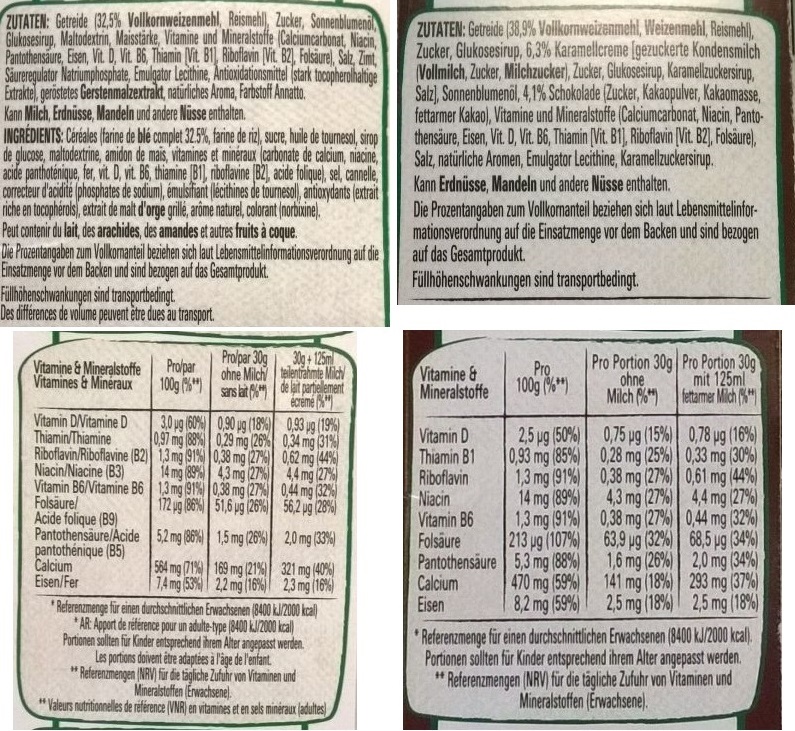
Bei einer Blutuntersuchung ergab sich eine Ferritinkonzentration von 13 ng/ml Blut. (Unter Ferritin versteht man eine Gruppe von löslichen Transport-Proteinen für Eisen.) Dieser Wert liegt unterhalb des Richtwertes von 15-80 ng/ml für Jugendliche im Alter von 10-15 Jahren. Die Diagnose lautet dann oft Eisenmangel im gesamten Körper, weil der Ferritingehalt im Blut ein leicht bestimmbarer Wert ist und einen relativ sicheren Hinweis auf den Gehalt an Eisen in den anderen Körperteilen gibt. Es handelt sich hierbei stets um gelöstes Eisen, also Fe2+ oder Fe3+ - Ionen, die auch komplex gebunden vorliegen können. Das Spuren-Element Eisen ist im Körper mit ca. 4 g enthalten, wovon 70 % an den roten Blutfarbstoff Hämoglobin gebunden sind. 10 % des Gesamteisens sind an das Muskelprotein Myoglobin gebunden. Die Bindungen des Eisens an die jeweilen Proteine liegen übrigens stets als Komplexbindungen vor. (Spezialwissen über die Komplexverbindungen erhält man auf einer eigenen Webseitengruppe.) Die Hauptfunktion des gebundenen Eisens besteht darin, den Sauerstoff von den Lungen zu den Geweben zu transportieren. Der tägliche Eisenverlust über den Stuhlgang, Blutungen und Hautabschilferungen beträgt ca. 1 mg, sodass eine tägliche Zufuhr von 10 mg Eisen über die Nahrung empfohlen wird. Durch Darm-Resorption gelangen dann ca. 10 % davon in den Stoffwechsel. Eisen ist aber auch wichtiger Bestandteile von Enzymen ganz besonders der Atmungskette, den Cytochromen. Eisenmangel kann deshalb zu Müdigkeit, Kopfschmerzen und allgemeinem Leistungsabfall führen. [1] Möchte man den Anteil an Eisen über die Nahrung aufnehmen, so gibt es grundsätzlich bestimmte Lebensmittel mit einem relativ hohen Eisengehalt. Viel Eisen ist in Blutwurst und magerem Fleisch, besonders Herz und Leber, enthalten. Der Gehalt liegt hier zwischen 2,5 – 8 mg/100 g Lebensmittel. Einige Gemüsesorten enthalten mittlere Mengen von 0,5 – 5 mg/100 g, während Obst und Milchprodukte nur sehr wenig zu einer Eisenversorgung beitragen. Anders als immer angenommen wird, trägt Spinat kaum zur Eisenversorgung bei… Ernährt man sich vegetarisch, so begibt man sich schnell auf die Suche nach den Gemüsesorten mit einem möglichst hohen Eisengehalt. Quelle: [7] Nimmt man entsprechende Mengen täglich auf, so könnte man meinen, die Eisenzufuhr wäre gesichert. Leider kommt aber hinzu, dass bestimmte Lebensmittel wie Tee, Kaffee, Milchprodukte und Weißmehlprodukte die Resorption der nötigen Menge an Eisen pro Tag hemmen. Bei vielen Menschen besteht aber das tägliche Frühstück gerade mal aus einer Mischung aus Weißmehlprodukten und Milchprodukten. Fleisch wird in mitteleuropäischen Kulturkreisen eher selten zum Frühstück genossen. Durchforstet man die Angebotspalette unterschiedlicher Cerealienhersteller, so stellt man fest, dass der Eisengehalt auf der Packung angeben ist. Bild 2: Inhaltsangaben auf der Packung von zwei Produkten eines Anbieters
In beiden Fällen wird Eisen angegeben. Hier stellt sich sofort die Frage nach der Form, in der das Eisen in dem Lebensmittel vorkommt. Experiment: Magnetischer Nachweis von elementarem Eisen in Müsli Für den Nachweis von elementarem Eisen sollte man eine ganze Packung (je nach Produkt 375 g oder 400 g) der Cerealien in der geschlossenen Packung zu einem Pulver zerdrücken. Anschließend füllt man 300 ml Leitungswasser hinzu und stellt einen Brei her. Mit Neodym-Scheibenmagneten oder einem anderen starken Magneten sammelt man von außen das feine Eisenpulver zusammen. Dabei sollte man den Magneten von der unteren Beutelseite langsam zur Oberseite des Beutels führen, um möglichst viel Eisen am Magneten zu sammeln. Bild 3: Cerealienbrei in einer Kunststofftüte
Beobachtungen:
Bild 4: Eisenpulver mit dem Magneten gesammelt
(Foto: Schorn)
Wie kann man den Ferritingehalt im Blut steigern?
Ärzte empfehlen gerne entweder eine eisenhaltige Ernährung oder verschreiben sogenannte Eisenpräparate, deren Kosten nur zum Teil von den Krankenkassen übernommen werden, da es sich meist nicht um Medikamente handelt, sondern um Nahrungsergänzungsmittel. Das sind die sogenannten Vitamintabletten oder Mineralientabletten, die man in jeder Drogerie oder bei jedem Discounter kaufen kann.
Lebensmittel
Eisengehalt mg/100 g
Weizenkleie
15
Hirseflocken
9
Kürbiskerne
11,2
Pinienkerne
9,2
Sojabohnen getrocknet
9,7
(Foto: Schorn)
In welcher Form liegt das Eisen in diesen Produkten vor?

(Foto: Schorn)
An der Innenseite des Kunststoffbeutels hängen feine Eisenfeilspäne.
(Foto: Schorn)
Kann man einfach Eisenpulver schlucken oder eisenhaltige Gegenstände lutschen, um dem Körper seinen täglichen Bedarf an Eisen zu geben?
Unser Körper nimmt das Element Eisen nur als gelösten Stoff auf. Um das zu erreichen, muss metallisches Eisen oxidiert werden. Aus dem Haushalt und der Presse kennt man unterschiedliche Tipps, um das zu erreichen.

Bild 5: Mit Eisennägeln gespickter Apfel
(Foto: Schorn)
Z.B. kann man Eisennägel in einen säurehaltigen Apfel stecken und den Apfel dann nach einer gewissen Zeit zusammen mit dem oxidierten Eisen verspeisen [2].
Aus einer Studie von 1997 [3] geht hervor, dass der Gebrauch von eisenhaltigem Kochgeschirr einen sehr guten Beitrag zu einer eisenhaltigen Ernährung darstellt. Der Eisengehalt war in dieser Studie bei 18 von 20 Gerichten nach dem Kochen in dem Eisengeschirr viel höher, als wenn Geschirr aus Aluminium verwendet wurde.
2008 wurde von kanadischen Gesundheitsforschern der lucky iron fish im Zuge einer Gesundheitskampagne gegen die in Kambodscha unter Frauen weit verbreitete Anämie eingesetzt [4] und [5]. Darunter versteht man ein aus Gußeisen hergestelltes Produkt in Form eines Fisches.
Für eine bessere Aufnahme des Eisengehalts aus eisenhaltigen Lebensmitteln wird gleichzeitig die Aufnahme von Vitamin C, also Ascorbinsäure empfohlen.
Chemisch laufen hierbei sogenannte Redoxreaktionen ab, wobei das Eisen mit der entsprechenden Säure reagiert.
(1) Fe + 2 H+ -> Fe2+ + H2
Eisen + Wasserstoff-Ionen (von der jeweiligen Säure) -> Eisen-Ionen + Wasserstoff
Im Apfel befindet sich Äpfelsäure, sodass an der Kontaktstelle zwischen Nagel und Apfel Eisenmalat entsteht. (Malat ist das Salz der Äpfelsäure; lat. Malum, Apfel.)
(2) Eisen + Äpfelsäure -> Eisenmalat + Wasserstoff
Gelangt das Eisenpulver über das Müsli in unseren Magen, der Salzsäure enthält, so entsteht Eisen-(II)-chlorid.
(3) Fe + 2 HCl -> FeCl2 + H2
Eisen + Salzsäure -> Eisenchlorid + Wasserstoff
Als Ergebnis erhält man in allen Fällen gelöstes Eisen, das vom Darm resorbiert werden kann.
Wie kann man den Eisengehalt von Lebensmitteln bestimmen?
Den Eisengehalt in Lebensmitteln kann man mit unterschiedlichen Methoden bestimmen.
1. Mit Hilfe von Teststreifen bzw. reflektometrisch
|
Experiment: Bestimmung des Eisengehalts als Fe2+-Ionen in Rotbäckchensaft. Bei dieser Methode wird ein Teststreifen mit einer Testreagenz kurz in die zu testende Flüssigkeit gehalten und anschließend die Intensität der Färbung bestimmt, die sich aus der chemischen Reaktion zwischen dem gelösten Eisen und der Testreagenz ergibt. Nach dem Prinzip der Reflektometrie bzw. Remissionsphotometrie wird am Analysestäbchen reflektiertes Licht exakt gemessen. Wie in der klassischen Photometrie kann über die Intensitätsunterschiede von ausgehender und reflektierter Strahlung die Konzentration bestimmter Inhaltsstoffe quantitativ gemessen werden.
Bild 6: Reflektometer mit Probenlösung und passenden Teststreifen
Für eine Messung der Konzentration an Fe2+-Ionen benötigt man neben dem Gerät noch die passenden Teststäbchen. Hierbei wird ein Barcodestreifen mitgeliefert. 1. Geräte einschalten und den passenden Barcodestreifen nutzen, um die Messmethode stoffspezifisch festzulegen.
Bild 7: Messung der Fe2+ Konzentration von Rotbäckchensaft
Ergebnis: Der Messwert 1,2 mg/L gibt aufgrund der Verdünnung ein 1/30 der tatsächlichen Konzentration im Rotbäckchensaft an. Die Konzentration beträgt 36 mg/L. Bei einem Vergleich mit der Angabe auf der Getränkeflasche (3,5 mg/100 mL) ergibt sich ein sehr guter Messwert mit dieser Methode. Im Rotbäckchensaft ist das Element Eisen als Eisen-(II)-gluconat vorhanden. |
2. Mit Hilfe einer Verdünnungsreihe und eines kolorimetrischen Vergleichs
|
Experiment: Bestimmung des Eisengehalts als Fe3+-Ionen in einem mit Eisennägeln gespicktem Apfel. Bei dieser Methode wird das zu untersuchende Lebensmittel in einem Tiegel verglüht, sodass sämtliches Eisen in Form von Fe3+-Ionen (Eisensalze oder Eisenoxide) als Rückstand im Tiegel verbleiben. Anschließend werden diese Rückstände mit Salzsäure gelöst und mit Ammoniumthiocyanat versetzt. Dabei entsteht ein rot-violetter Farbkomplex, dessen Farbintensität mit einer vorbereiteten Verdünnungsreihe verglichen wird.
Bild 8: Untersuchungsmaterial – Ein mit Eisennägeln für 1 Stunde gespickter Apfel.
Man kann an den Nägeln sehr gut die Flecken des Eisenmalats erkennen, das auch für die Dunkelfärbung im Apfelinneren verantwortlich ist. 1. Probe vorbereiten.
Bild 9: Probe abwiegen (links), mehrere Proben, die 20 min lang geglüht werden (rechts)
c. Nachdem der Tiegel abgekühlt ist, werden Rückstände aus dem Tiegel mit halbkonzentrierter Salzsäure aufgelöst und gegebenenfalls abfiltriert, sodass keine Aschereste die anschließende Farbreaktion beeinträchtigen. Zum Spülen ergänzt man bei Bedarf destilliertes Wasser bis zu einem Volumen von 10 mL.
2. Verdünnungsreihe herstellen
c. Man ergänze zu den Lösungen jeweils noch 2 mL konzentrierte Salzsäure und fülle bis zur Eichmarke mit destilliertem Wasser auf. Man erhält die fertige Verdünnungsreihe mit den angegebenen Massenanteilen w.
Bild 10: Verdünnungsreihe
3. Herstellen der kolorimetrischen Vergleichsreihe
Fe3+ (aq.) + 6 NH4SCN (aq.) -> [Fe(SCN)6]3- (aq.) + 6 NH4+ (aq.)
(Für Spezialisten: http://www.chemieunterricht.de/dc2/komplexe/reakstab.htm) Diese Komplexe sind im Essigsäureethylester, also in der oberen Phase, besser löslich als im Wasser.
Bild 11: Kolorimetrische Vergleichsreihe Nr. 1 links bis Nr. 10 rechts
Man erkennt hier sehr gut, dass sich der Farbkomplex in der organischen Phase (unpolares Lösemittel) besser löst als in der wässrigen Phase. 4. Eisenbestimmung mit den vorbereiteten Probelösungen aus Schritt 1
5. Ergebnis der Bestimmung des Eisengehalts in einem mit Eisennägeln gespicktem Apfel.
Bild 12: Kolorimetrische Messung für „Eisenapfel“
b. Die Farbintensität der Apfelprobe (vorne im Bild 14) liegt zwischen dem 8. und 9. Glied der Vergleichsreihe. Das entspricht einem Massenanteil im Eisenapfel von 3,36-4,48 mg/100 g „Eisenapfel“. Zum Vergleich enthalten normale Äpfel ohne die Vorbehandlung mit Eisennägeln nur einen Massenanteil von 0,056-0,223 mg/100 g. |
Um auf den von der Deutschen Gesellschaft für Ernährung e.V. (DGE) empfohlenen täglichen Anteil von 10-15 mg/Tag an Eisen zu kommen [6], müsste man von solch einem Apfel also nur noch 200 - 300 g essen.
So kann man auch auf einfache Art und Weise den Eisengehalt von Lebensmittel steigern und muss nicht gleich auf käufliche und meist teure Produkte der Nahrungsergänzungsmittelindustrie zurückgreifen. Wem ein solch schwarzbrauner Apfel eher den Appetit verdirbt, der kann besser auf den Trick mit dem „Glücklichen Eisenfisch“ zurückgreifen.
Quellen:
[1] Hauber-Schwenk, Gaby; Schwenk, Michael; dtv-Atlas Ernährung; Deutscher Taschenbuch Verlag GmbH & Co. KG München 2000
[2] Stimmt's / Stimmt’s: Nagel im Apfel. Eine Kolumne von Christoph Drösser; DIE ZEIT 28.10.2004 Nr.45
[3] JIEUN PARK,; HELEN C BRITTIN; Increased Iron Content of Food Due to Stainless Steel Cookware; In Journal of the american dietetic; Volume 97, Issue 6, Pages 659–661; June 1997
[4] https://en.wikipedia.org/wiki/Lucky_iron_fish (abgrufen am 25.10.2018)
[5] https://luckyironfish.com/ (abgrufen am 25.10.2018)
[6] https://www.dge.de/wissenschaft/referenzwerte/eisen/ (abgrufen am 25.10.2018)
[7] https://www.eisencheck.at/eisen-im-koerper/eisenhaltige-lebensmittel/ (Abgrufen am 25.10.2018)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 4. November 2018, Fritz Meiners






