Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Mai 2019 (Tipp-Nr. 263)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wie gelingt das verkehrt herum gekochte Ei?
Jens Schorn
Bild 1: Verkehrt herum gekochte Eier – links im Bild
Dieses Einstiegsbild ist gut geeignet für ein Kochformat des deutschen Fernsehens, bei dem es darum geht, fertige Gerichte, die in einer Box serviert werden, nur anhand der Verkostung und des Aussehens in einer Originallokation (der Ort, von dem das Gericht stammt) nachzukochen. Oder man nutzt es für ein sogenanntes Kopfballexperiment, bei dem man Geräte und Chemikalien vorgestellt bekommt, mit deren Hilfe man solch ein Ei zubereiten soll. Tipps zum Zubereiten von perfekt gekochten Eiern findet man an vielen Stellen [1].
Hier geht es meist darum, dass man für das Zubereiten des perfekten Eis den Umfang des Eis, die Starttemperatur und Kerntemperatur (Dottertemperatur) des fertigen Eis, sowie die Abhängigkeit der Siedetemperatur des Kochwassers von der Höhenlage über N.N. berücksichtigt [4].
Die Chemie der Zubereitung von Eiern gelangte in den letzten Jahren durch die Mode des Garens auf kleiner Flamme [2] bis in die „Haut Cuisine“ z. B. des Hotels Regent Berlin [5]. Dort nutzte der Sternekoch Christian Lohse die Kenntnisse aus der Wissenschaft [7] und entwickelte aus einem häuslichen Rezept für „Verlorene Eier“ verschiedene Varianten des Onsen-Eis, wie es im Bild 1b links in der Petrischale zu sehen ist [6]. Onsen ist übrigens die japanische Bezeichnung für heiße Quellen mit einer Wassertemperatur zwischen 60-70 °C. Bild 2: Ein Onsen-Ei in der linken Petrischale. In der rechten Schale befindet sich bei gleicher Temperatur gegartes Eiweiß
1. Warum bleibt ein Teil des Onsen-Eis eher flüssig, während der andere Teil fest wird? Hierzu kann man in Anlehnung an die oben genannten Rezepte oder Anleitungen die Entstehung des Onsen-Eis im Experiment nachvollziehen. Es wird die Verfestigung von Eigelb und Eiweiß in Abhängigkeit von der Temperatur getrennt untersucht. Experiment 1: Gerinnungstemperatur von Eiweiß und Eigelb (variiert nach [7]) Geräte: vier Bechergläser (250 mL), Thermometer, Leitungswasser, zwei Hühnereier, Wasserkocher oder Heizplatte mit Thermostatregulierung. Durchführung:
Die rohen Hühnereier werden aufgeschlagen und das Eiklar vom Eigelb getrennt. Das Eigelb wird in Becherglas 1.1. und 2.1., das Eiweiß in Becherglas 1.2. und 2.2. gegeben. Bild 3: Eigelb und Eiklar für unterschiedlich temperierte Wasserbäder; links 65-70 °C, rechts 75-80 °C
Beobachtung:
Bild 4: Eiweiß und Eigelb nach dem Erwärmen in Bechergläsern
Das Eigelb im linken Becherglas bei niedriger Temperatur hat eine feste Haut bekommen, ist aber immer noch relativ flüssig, während das Eigelb im rechten Becherglas bei hoher Temperatur komplett fest ist.
Bild 5: Testen der Konsistenz von Eiweiß und Eigelb nach der Temperaturbehandlung
Ergebnis:

(Foto: Schorn)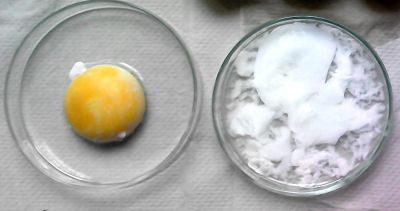
(Foto: Schorn)
Wie kann man aber solche Eier herstellen?
Die Suche nach der Antwort unterteilt sich in zwei Bereiche:
Man bereitet vier Bechergläser mit 150 mL Wasser unterschiedlicher Temperaturen vor.

(Foto: Schorn)
Nach einer Zeit von 1 h und 20 min ergibt sich folgendes Bild. 
(Foto: Schorn)
Das Eiweiß im linken Becherglas bei niedriger Temperatur ist milchig aber noch komplett flüssig, während das Eiweiß im rechten Becherglas bei hoher Temperatur vollständig verfestigt ist.
Auch wenn man die Bestandteile aus den Bechergläsern holt, kann man die Konsistenz durch Drücken und Schneiden bestätigen. 
(Foto: Schorn)
Eigelb gerinnt über eine längere Zeit des Erwärmens schon bei niedrigen Temperaturen im Bereich von 65-70 °C, während Eiweiß zum Gerinnen eine um ca. 10 °C höhere Temperatur benötigt.
Warum werden Eiklar und Eigelb bei unterschiedlichen Temperaturen fest?
Der Prozess der hier zugrunde liegt, wird Denaturierung genannt und beschreibt eine dauerhafte Strukturveränderung von Proteinen, die durch unterschiedliche Faktoren herbeigeführt werden kann. Hier liegt es an der Temperatur bei der sich die unterschiedlichen Proteine von Eiklar und Eigelb verfestigen.
| Protein | Proteinanteil im Eiklar [%] | Denaturierungs-temperatur [°C] | Strukturelle Hinweise |
| Ovalbumin | 58 | 77 | Sphäroprotein mit Kugelform; besteht aus 385 Aminosäure-Bausteinen; denaturiert bereits durch kräftiges Schlagen, z. B. mit dem Schneebesen, an der Grenzfläche zu Luft |
| S-Ovalbumin | variabel | 85 | Hitzestabile Form des Ovalbumins; bildet sich auf natürliche Weise bei der Lagerung und beim Erhitzen; entsteht aus Ovalbumin; |
| Ovotransferrin | 13 | 60 | Kugelförmiges Sphäroprotein; besteht aus 686 Aminosäuren |
| Ovomucoid | 11 | hitzestabil | Enthält an Asparagin-Reste gebundene Monosaccharide; verfügt über einen hohen Anteil an Disulfidbrücken |
| Ovomucin | 3,5 | 70 | Relativ kleines Protein; schließt sich zu faserartigen Strukturen zusammen; bedingt die hohe Viskosität der zähen Eiklar-Schicht |
Tabelle 1: Übersicht der Inhaltsstoffe von Eiklar [3]
Bei einem Vergleich der Proteinanteile in Eiklar und Eiweiß wird deutlich, dass der Anteil an Ovotransferrin, das schon bei 60 °C denaturiert, im Eiklar nur 13 % ausmacht. Hingegen ist der Anteil an Ovotransferrin und anderen Proteinen, die schon bei niedriger Temperatur denaturieren im Eigelb höher, sodass das Eigelb schon im Temperaturbereich von 65-70 °C anfängt zu denaturieren [3].
Interessant ist hierbei, dass die Gerinnung des Eigelbs sehr stark von der Zeit abhängt [7]. Deshalb werden die Onsen-Eier auch mindestens 45 Minuten in einem Wasserbad bei 64,5 °C gegart [11].
2. Wie gelangt beim umgekehrt gekochten Ei das Eigelb nach außen und das Eiklar nach innen?
|
Experiment 2: Trennung von Eiklar und Eigelb durch Zentrifugation Materialien: Hühnerei, Nylonstrumpf oder Nylonstrumpfhose, Schere, Metalldraht oder Schnur, Klebefilm.
Bild 6: Materialien für die Eizentrifuge
Durchführung:
Bild 7: Durchleuchtetes Ei vor nach dem Zentrifugieren
2. Das rohe Ei wird vorsichtig vollständig mit Klebefilmstreifen beklebt. Dies dient dazu, um die Schale vor dem Zerbrechen zu schützen.
Bild 8: Beklebtes Ei
3. Den Nylonstrumpf in der Mitte mit einem Knoten versehen. 4. Das beklebte Ei wird in den Strumpf bis zum Knoten hineingeschoben und auf der knotenabgewandten Seite mit einem Metalldraht oder einer Schnur (soll sich später wieder öffnen lassen) in dem Strumpf fixiert.
Bild 9: Fertige Eizentrifuge mit Ei
5. Die beiden Enden des Strumpfes fest greifen und vor dem Körper stark in eine Richtung, wie beim Seilspringen, drehen. Das Ei anschließend zurückdrehen lassen. Das ganze 5-10 Mal wiederholen. Hierbei kommt es darauf an, dass sich das Ei sehr schnell um die eigene Achse dreht. Das gelingt am besten, indem man den Strumpf nach dem Eindrehen kräftig aber gefühlvoll (es ist ja immer noch ein rohes Ei) mit beiden Händen auseinanderzieht. 6. Das rohe Ei mit der Lampe (Handy geht auch) erneut testen. Das Ei sollte nur noch rotes Licht durchscheinen lassen.
Bild 10: Ei nach dem Zentrifugieren
7. Das Metallband oder die Schnur auf der einen Seite des Strumpfes entfernen und das Ei aus dem Strumpf herausnehmen. 8. Das Ei (mit den Klebestreifen) zusammen mit einem nicht geschleuderten Ei zum Vergleich 15 Minuten kochen. 9. Anschließend das Ei vorschichtig vom Klebefilm befreien und schälen. Guten Appetit. Ergebnis:
Bild 11: Zwei halbe Eier im Vergleich. Links das geschleuderte Ei
|
Die Stofftrennung könnte an der unterschiedlichen Dichte von Eigelb und Eiweiß liegen. Durch die Behandlung des Eis in der Strumpfschleuder wirken auf die Stoffe Zentrifugalkräfte, die zu einer Auftrennung der Stoffe unterschiedlicher Dichte führen müssten. In der Lebensmittelchemie erfolgt die Auftrennung der Inhaltsstoffe von Eiern in Ultrazentrifugen, die durch höhere Geschwindigkeiten eine sehr genaue Auftrennung erreichen können [10].
|
Experiment 3: Eigelb und Eiweiß in einer Handzentrifuge Materialien: Handzentrifuge mit passenden Zentrifugengläsern, Hühnerei, Bechergläser und Tropfpipetten.
Bild 12: Materialien für das Zentrifugieren
Durchführung:
Bild 13: Zwei Zentrifugengläser im Becherglas mit Eigelb auf Eiweiß geschichtet
Bild 14: Zentrifuge im Einsatz
Ergebnis:
Bild 15: Ei nach dem Zentrifugieren
|
Diese Beobachtung kann man erklären, wenn man die Dichte von Eigelb und Eiklar als Stoffgemisch näherungsweise berechnet. Hierzu benötigt man die Anteile der einzelnen Inhaltsstoffe, sowie die jeweiligen Dichten.
Das Eigelb macht 33 %, das Eiklar 57 % des Gesamteis aus [8]. Die jeweilige Zusammensetzung kann man den beiden folgenden Tabellen entnehmen.
| Name des Bestandteils | Prozentualer Anteil [%] | Dichte [g/cm³] |
| Wasser | 88 | 0,997 |
| Proteine (Hauptanteil Ovalbumin) | 10 | 1,04 (in wässriger Lösung) |
| Kohlenhydrate (Hauptanteil Glukose) | 0,9 | 1,54 |
| Lipide | 0,1 | 0,9 |
| Mineralstoffe (Natrium- und Kaliumsalze am häufigsten) | 1 | 2,16 (für Natriumchlorid) |
Tabelle 2: Bestandteile von Eiklar [3;9;10]
| Name des Bestandteils | Prozentualer Anteil [%] | Dichte [g/cm³] |
| Wasser | 49 | 0,997 |
| Eiweiß (Hauptanteil Ovomucoid) | 16 | 1,04 (analog zu Ovalbumin) |
| Fett | 33 | 0,9 |
| Kohlenhydrate | 1 | 1,54 |
| Mineralstoffe (Natrium- und Kaliumsalze am häufigsten) | 1 | 2,16 (für Natriumchlorid) |
Tabelle 3: Bestandteile von Eigelb [3;9;10]
Zur Berechnung der Dichte eines Stoffgemisch dmi kann man in Anlehnung an den Tipp des Monats 261 die Summe der Produkte aus Massenanteil mi und dessen Dichte di geteilt durch die Gesamtmasse mG des Gemischs nach Formel (1) berechnen.
(1) dmi = ∑mi · di / mG
Verwendet man die Formel zur Berechnung der Gesamtdichte von Eigelb bzw. Eiweiß (eine Volumenkontraktion, die bei ineinander gelösten Stoffgemischen auftritt, bleibt unberücksichtigt), so ergibt sich für das Eigelb eine kleinere Dichte 0,98 g/cm3 als für das Eiweiß 1,01 g/cm3.
Dies erklärt die geringe Durchmischung der beiden Schichten bei einer reinen Zentrifugation.
Warum findet dennoch ein Austausch von Eigelb und Eiweiß in der sogenannten Ei-Schleuder statt?
Hierzu kann man das folgende physikalische Experiment durchführen.
|
Experiment 4: Ein aufgeschlagenes Ei im rotierenden Glas Materialien: Experimentiermotor mit einem rotierenden Becher, Kunststoffbecher und kleines Becherglas für die Flüssigkeiten, rohes Ei.
Bild 16: Aufbau für die Untersuchung der Rotation eines rohen Eis
Durchführung:
2. Nach der Beobachtung und dem Anhalten des Motors zersticht man mit einem Löffel das Eigelb und reguliert die maximale Umdrehung wieder bis 450 U/min und lässt das Ei 3 min rotieren. Beobachtung:
Bild 17: Rotiertes Ei mit intaktem Eigelb
2. Das Eigelb und das Eiklar werden durch die Rotation an die Glaswand gedrückt und steigen dort bis zur Hälfte des Glases hoch. Nach dem Anhalten des Motors befindet sich das Eigelb am Rand des Becherglases und verlangsamt seine Rotationsgeschwindigkeit relativ zum Eiklar sehr stark. Das Eiklar dreht sich im Rotationsmittelpunkt des Becherglases noch länger weiter. Dort ist zum Teil eine Wirbelbildung zu erkennen.
Bild 18: Sich ausdrehendes Ei. In der Mitte ist das z.T. verwirbelte Eiklar zu erkennen.
Ergebnis:
|
Wieso findet die Umverteilung von Eigelb und Eiklar erst beim Abbremsen der Rotation statt?
In beiden Fällen werden Eiklar und Eigelb durch die hohe Rotationsgeschwindigkeit an die Becherglaswand geschleudert. Auf jedes Teilchen der beiden Stoffgemische wirken drei Kräfte:
- die Schwerkraft m·g (senkrecht nach unten wirkend)
- die Zentrifugalkraft m·w²·r (senkrecht zur Becherglaswand wirkend)
- die Auftriebskraft FA (senkrecht zur Flüssigkeitsoberfläche wirkend).
In zwei der hier dargestellten Kräfte der Physik spielt die Masse m eine Rolle. Demnach sollten Teilchen mit einer größeren Masse und größeren Dichte in dem Experiment nach außen geschleudert werden. Wie oben mit Tabelle 2 und Tabelle 3 gezeigt, sind die Dichte und die Masse der Bestandteile von Eiklar größer als die der Stoffe von Eigelb. Auch die einfache Zentrifugation in Experiment 3 hat gezeigt, dass auf diese Weise keine Umkehr von Eigelb und Eiklar stattfindet.
Die Trennung und Umkehr von Eiklar und Eigelb erfolgt beim Abbremsen des flüssigen Eigelbs und des zähflüssigen Eiklars. Wird der Becher abgebremst, so wird durch die Reibungskraft zwischen der Glaswand und den Flüssigkeitsteilchen die Drehgeschwindigkeit (der Physiker spricht hierbei von der Winkelgeschwindigkeit) der Teilchen kleiner.
Nach den beiden Teilbeobachtungen müssen wir den Zusammenhalt von Eigelb durch die Eidotterhaut (in Experiment 4.1) und den Zusammenhalt von Eiklar in beiden Teilexperimenten vergleichen. Es muss davon ausgegangen werden, dass die Eidotterhaut im rohen Ei durch die starke Zentrifugation in der Eizentrifuge zerstört wird.
Während sich die Teilchen des Eigelbs in der Flüssigkeit relativ frei bewegen können, führen die auf jedes Teilchen wirkende Zentrifugalkraft und Schwerkraft dazu, dass sich die Flüssigkeitsteilchen an die Becherglaswand bewegen. Teilchen aus dem Eiklar, die durch die Zähigkeit des Ovomucin (für die Viskosität verantwortlich) zusammengehalten werden, sind durch diese Bindungskräfte der faserartigen Strukturen nicht so frei beweglich, wie die Teilchen des Eigelbs. Deshalb sammelt sich das Eiklar als zähflüssige Masse in der Mitte des rotierenden Glases.
Will man nun zu Ostern solch umgekehrt gekochte Eier in Serie herstellen, so empfiehlt es sich, möglichst frische Eier zu verwenden, da das Eiklar mit der Lagerzeit an Viskosität verliert. Die faserigen Strukturen des Ovomucin zersetzen sich während der Lagerung [3]. Das Eiklar wird mit der Zeit flüssiger, verliert seinen Zusammenhalt und der Effekt des Umkehrens beim Abbremsen in der Eischleuder führt nur zu einer schlechten Trennung von Eiklar und Eigelb.
Frohe Ostern und guten Appetit.
Quellen:
[1] http://www.chemieunterricht.de/dc2/grundsch/eier/eier1/vorlagen.htm (abgerufen am 25.3.2019)
[2] https://www.zeit.de/news-022011/20/iptc-bdt-20110220-290-28831594xml (abgerufen am 17.3.2019)
[3] Roth, Klaus: „Hart oder Weich - Allerlei vom Frühstücksei“ in Chemie in unserer Zeit; Vol 43 Issue 2, S. 61-; DOI: 10.1002/ciuz.200900485
[4] https://www.mn.uio.no/kjemi/tjenester/kunnskap/egg/
[5] https://www.regenthotels.com/regent-berlin/dining (abgerufen am 24.3.2019)
[6] https://www.zeit.de/2010/14/Ei-Onsen
[7] http://www.fooducation.org/2011/02/6x-c-egg-or-opposite-boiled-eggs.html#more
[8] Schwedt, Georg; Taschenatlas der Lebensmittelchemie; Thieme Verlag 1999; Stuttgart.
[9] Harriette Chick; Charles J. Martin; Die Dichte und das Lösungsvolumen einiger Proteine; Zeitschrift für Chemie und Industrie der Kolloide; February 1913, Volume 12, Issue 2, pp 69–71
Link: https://link.springer.com/article/10.1007/BF01503400 (abgerufen am 26.3.2019)
[10] von H.-D. Belitz, Werner Grosch, Peter Schieberle, Lehrbuch der Lebensmittelchemie; Springer Verlag 2013 S.536 ff.
[11] https://www.gourmet-blog.de/das-perfekte-ei-garen-das-beruhmte-onsen-ei/ (abgerufen am 16.3.2019)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. April 2019, Fritz Meiners












