Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Juli 2019 (Tipp-Nr. 265)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Uwe Lüttgens
„Ein Mol? Das sind unvorstellbar viele Teilchen, mehr als 600 Trilliarden.“ So oder ähnlich antworten alle, die im Chemieunterricht aufgepasst haben. Und so steht es bisher im Chemiebuch: Die Stoffmenge n = 1 mol gibt an, dass diese Stoffportion aus etwa 6 · 1023 gleichartigen Teilchen besteht [1]. Dieser Wert für Anzahl der Teilchen in einem Mol eines Stoffes kommt uns bekannt vor, es ist die sogenannte Avogadro-Konstante NA. In Chemiebüchern, beispielsweise auch im „Holleman-Wiberg“ in der aktuellen 102. Auflage von 2007 [2], wird der Wert der Avogadro-Konstante angegeben: NA = 6,0221367 x 1023 mol-1 Interessanterweise findet sich im Anhang im gleichen Buch der Wert „geringfügig“ verändert; einige Hundertbilliarden Atome sind jetzt einfach hinzugekommen. NA = 6,0221415 x 1023 mol-1 [2, S. 1993] In einem älteren Buch zur Atomphysik aus dem Jahr 1967, das ich in meinem Bücherschrank gefunden habe, fällt der „zur Zeit besten Wert“ deutlich höher aus: NA = 6,02295 ± 0,00005 x 1023 mol-1 [3] Offensichtlich hat sich der Wert in Laufe der Jahre geändert, sicherlich verbessert, was eine Folge verfeinerter Messverfahren ist. Dazu in einem späteren Tipp des Monats mehr. Der aktuell genaueste Wert für die Anzahl von Atomen in einem Mol eines Stoffes, auf dessen Grundlage die Einheit Mol neu definiert worden ist, stammt aus dem Jahr 2016 und wurde im Rahmen des Avogadro-Projektes unter Federführung der Physikalisch-Technische Bundesanstalt (PTB) bestimmt: NA = 6,022 140 76 x 1023 mol-1 [4] Damit konnte vor kurzen, am 20. Mai 2019 ein neues internationales Einheitensystem – kurz SI (frz. Système international d’unités) – in Kraft treten. Neben der Avogadro-Konstante bilden weitere sechs Naturkonstanten die Grundlage für die Definition von Kilogramm, Mol, Ampere und Kelvin sowie Sekunde, Meter und Candela. Bild 1: Siliciumeinkristalle, hergestellt im Zonenschmelzverfahren
Werden diese zu Kugeln geformt, ist „nur“ der Kugeldurchmesser zu bestimmen. Denn dann kennt man ja auch das Kugelvolumen. In einem zweiten Schritt werden die sogenannten Gitterparameter vermessen – das sind Angaben zum Abstand zwischen den einzelnen Atomen im Kristallgitter. Die kleinste sich periodisch wiederholende Baueinheit – sie wird als Elementarzelle bezeichnet – besteht aus 8 Siliciumatomen. Diese Elementarzelle wiederholt periodisch im ganzen Kristall. Die Anzahl der Atome in der Silicium-Kugel kann berechnet werden, denn nun sind das Volumen der Siliciumkugel VKugel und das Volumen der kleinesten Baueinheit, dem Atom VAtom bekannt. Bild 2: Das Messprinzip bei Avogadro-Projekt ist denkbar einfach
Ist die Anzahl der Atome bekannt, kann damit die Avogadro-Konstante NA berechnet werden. Vorausgesetzt, die Molare Masse MMol und die Masse der Kugel mKugel sind ebenfalls bekannt: NA = VKugel · MMol / VAtom · mKugel Die Masse der Kugel mKugel wird durch Wägung bestimmt – dabei wird letztlich mit dem Urkilogramm verglichen. Damit ist auch die Masse eines Silicium-Atoms bekannt. Die Molare Masse MMol errechnet sich aus den relativen Atommassen der drei natürlich vorkommenden Isotope und daraus, wie häufig sie in der Natur zu finden sind. Ausgehend von Siliciumtetrafluorid SiF4 wird dazu erst in einem Reinigungsschritt Silan SiH4 hergestellt und dieses Gas anschließend an heißen Oberflächen in polykristallines Silicium umgewandelt: SiH4 -> 2 H2 + Si Daraus soll nun ein perfekter Silicium-Einkristall entstehen. Aber was heißt „perfekt“ gebaut? Das Halbmetall kommt ja in der Natur nicht isotopenrein daher. Also müssen die beiden natürlich vorkommenden Isotope 29Si und 30Si möglichst vollständig entfernt werden, um später die molare Masse von Silicium-28 exakt bestimmen zu können. Perfekt gebaut heißt auch, dass alle dafür im Kristallgitter vorgesehenen Plätze nur ausschließlich von Silicium-Atomen besetzt werden – und sich keine Fremdatome dazwischenmogeln. Das geschieht im Zonenschmelzverfahren, bei dem ein polykristalliner Siliciumstab langsam durch einen Induktionsofen wandert, dort zonenweise schmilzt, dabei die lästigen Fremdatome verliert und anschließend mit einheitlicher Kristallstruktur wieder erstarrt. (Dahinter steckt die Schmelzpunktserniedrigung. Verunreinigte Stoffe haben einen niedrigeren Schmelzpunkt als die Reinstoffe… Dazu gibt es viele Texte auf unserem Server.) Fremdatome in kristallinem Silicium? Überwiegend sind das Kohlenstoff, Sauerstoff und Bor, Wenn sich Kohlenstoffatome auf die Gitterplätze des Siliciums mogeln, dann schrumpft der Siliciumkristall. Das C-Atom ist schließlich kleiner als das Si-Atom. Drängt sich Sauerstoff dazwischen – man spricht dann von Zwischengitterplätzen, weil die Gitterplätze besetzt sind -, quillt der Kristall hingegen auf. Beides sollte vermieden werden, wenn der Durchmesser der Kugel, den wir ja zur Berechnung des Volumens benötigen, gemessen werden soll. Die Zahl der Fremdatome konnte im Avogadro-Projekt auf „nur“ ca. 1015 pro Kubikzentimeter begrenzt werden. Eine Billiarde Fremdatome? Klingt viel, ist aber aktuell unschlagbar wenig. Der fertige Silicium-Einkristall enthält jetzt mehr als 99,995% 28Si-Atome. Jetzt muss die Kugel nur noch rund werden. Also wird poliert, bis die Abweichung von der idealen Kugelgestalt minimal ist. Wie macht man das technisch? Was heißt das konkret? Die Abweichung von der Kugelgestalt beträgt weniger als 40 nm - bei 93,7 mm Durchmesser der Siliciumkugel [4]. Zum Vergleich kann man sich vorstellen, die Kugel wäre die Erde: Auf unseren Trabanten bezogen würde die Höhendifferenz zwischen der Tiefsee und der höchsten Bergkuppe gerade mal 5,4 m betragen. Wahrlich beeindruckend! Das letzte Problem stellt die Oberfläche dar. Diese besteht keineswegs nur aus Silicium-Atomen, sondern aus einer SiO2-Oxidschicht. Und die wiederum ist von einer kohlenstoffhaltigen Schicht bedeckt, auf der sich zu allem Überfluss auch noch Wasser ansammelt. Anders gesagt: Auf der Kugeloberfläche befindet sich eine „Dreckschicht“ – ungünstig für eine exakte Messung! Wenigstens weiß man am Institut für Kristallzüchtung, dass diese Schicht ca. 3 nm dick ist. Auch nach dem Avogadro-Projekt wird im Chemieunterricht sicherlich weiterhin festgestellt werden: „Ein Mol? Das sind unvorstellbar viele Teilchen, mehr als 600 Trilliarden.“ Für den schul-chemischen Alltag reicht daher sicherlich weiterhin die bekannte Definition aus: 1 Mol ist die Stoffmenge, in der sich etwa 6 x 1023 Teilchen befinden.
Die Avogadro-Konstante
Der italienische Physiker Graf Amedeo Avogadro, der sich Anfang des 19. Jahrhunderts mit Daltons Atommodell beschäftigte, suchte nach einer Erklärung dafür, dass sich alle Gase, wenn sie erwärmt werden, exakt gleich stark ausdehnen. Jeweils gleiche Volumina der Gase mussten also, so Avogadros Schlussfolgerung, die genau gleiche Anzahl von Teilchen enthalten. Wie viele es sind, konnte Avogadro jedoch nicht bestimmen. Welche Möglichkeiten zum „Zählen von kleinsten Teilchen“ seitdem entwickelt wurden, wie also die Avogadro-Konstante bestimmt werden kann, wird in einem späteren Tipp erläutert.
Wie zählt man Atome? - Das Avogadro-Projekt
Alle Atome einzeln zu zählen, wäre schlichtweg nicht möglich. Was jedoch gut funktioniert, ist die Vermessung von Kristallen – genauer, von perfekt gebauten Silicium-Einkristallen, die sich dank der hochentwickelten industriellen Halbleiterproduktion sehr gut herstellen lassen.
(Copyright Shutterstock/Peter Sobolev)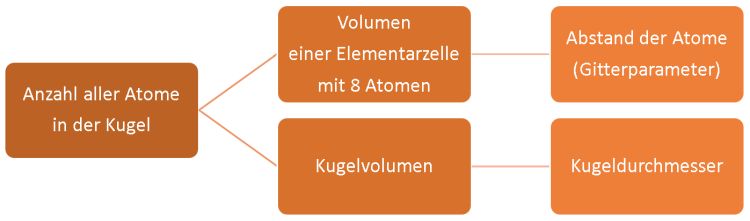
(Skizze: Lüttgens nach [4])
Bau einer perfekten Silicium-Kugel
Der Auftrag am Institut für Kristallzüchtung in Berlin-Adlershof, koordiniert von der PTB, lautete also: Baut mehrere fast perfekte Siliciumkugeln, die ca. 1 kg schwer sind, mit einer defektfrei polierten Oberfläche.
Die Neudefinition der Stoffmenge
Die Definition des Mols, die seit Mai 2019 gilt, wird zukünftig in Schulbüchern so oder ähnlich lauten: Die Stoffmenge n = 1 mol gibt an, dass diese Stoffportion aus genau 6,022 140 76 x 1023 gleichartigen Teilchen besteht.
Literatur:
[1] FOKUS Chemie 7/8, Berlin/Brandenburg, Cornelsen Schulverlage, Berlin 2016, S. 168
[2] Lehrbuch der anorganischen Chemie, A. F. Holleman, E. Wiberg, N. Wiberg, Walter de Gruyter, Berlin 2007
[3] Einführung in die Atomphysik, W. Finkelnburg, Springer-Verlag, Berlin 1967, S. 13]
[4] Atome zählen für Masse und Stoffmenge, P. Becker, H. Bettin, in: PTB-Mitteilungen 126 (2016), Heft 2 (abgerufen am 10.6.2019)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 21. Juni 2019, Fritz Meiners