Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Oktober 2019 (Tipp-Nr. 268)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Hypes um Aluminium – wie wär´s mit Tonerde?
Rüdiger Blume
Der Hype um Aluminium in Deodorants (Deos) ist überstanden – wann kommt der nächste? Zur Erinnerung: In Deos waren Aluminium-Verbindungen enthalten, vor allem Aluminiumchlorid. Das klingt schon ätzend…Kennt man doch das AlCl3 aus dem Chemieunterricht. War das nicht die Verbindung, die mit Wasser Salzsäure bildet? Zur Beruhigung: In den Deos war das harmlosere Chlorid-Hexahydrat AlCl3 · 6 H2O enthalten. Warum wurde das Al-Salz überhaupt den Deos zugesetzt? Dafür gab es zwei Gründe: 1. Al-Ionen wirken als Lewis-Säuren, die mit Wasser reagieren: Al-Salze wirken in wässriger Lösung also schwach sauer. Das kann man leicht zeigen: Versuch 1: Al-Salze in wässrigen Lösungen Zu jeweils 5 ml Wasser gibt man eine Spatelspitze Kalium-Aluminiumsulfat-Hydrat (Alaun), Aluminiumchlorid-Hexahydrat und Aluminium-Acetat. Kein wasserfreies Aluminiumchlorid verwenden! Dann wird der pH-Wert bestimmt. Dazu reicht es aus, Universalindikatorpapier zu verwenden.
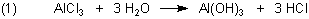
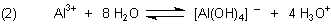
Ergebnis: Die Lösungen sind schwach sauer.
Man sagt, dass die Salze „adstringierend“ wirken (lat. stringo, zusammenschnüren). Diese leichte Säurewirkung schädigt die Schweißdrüsen, so dass diese weniger Schweiß absondern. Erinnert sei hier auch an den „Rasierstein“, der auch heute noch in vielen Badezimmerschränkchen zu finden ist. Ein Rasierstein ist nichts anderes als der klassische Kalium-Aluminium-Alaun (Kalium-Aluminiumsulfat-Hydrat KAl(SO4)2 · 12 H2O). Dessen adstringierende Wirkung zeigt sich beim Blutstillen. Denn mit Alaun werden Schnittwunden, die bei der klassischen Messer-Rasur auftreten können, behandelt. (Solche Rasiersteine wurden von angehenden Chemikern gerne zum häuslichen Kristallzüchten genutzt…)
2. Aluminium-Ionen wirken hemmend auf Bakterien, letztlich sogar abtötend (bakterizid). Die sorgten vor allem für die oftmals unappetitliche Geruchsbildung des Schweißes, weil sie die Hautfette hydrolysieren, wobei stinkende Fettsäuren freigesetzt werden.
Alle waren zufrieden.
Dann aber meinte man, einen Zusammenhang zwischen Brustkrebs und Deo-Gebrauch herstellen zu können. Das klingt eigentlich plausibel: In den hauptsächlich von Deos traktierten Achselhöhlen liegen Lymphdrüsen, die Leitungskontakt zum Milchdrüsengewebe der weiblichen Brust haben. Egal ob das bewiesen werden konnte oder nicht: Der daraus entstehende Hype sorgte dafür, dass die Deo-Industrie aufgeschreckt wurde und sofort reagierte: Heute gibt es kein Deo mehr, das Al-Salze enthält. Und dass dazu noch in den Ablagerungen im Gehirn von an Alzheimer erkrankten Patienten Al-Verbindungen gefunden wurden, gab den Aluminium-Salzen in Deos den völligen Knock out.
Umso erstaunlicher ist, dass sich trotz seines negativen Images Aluminium immer noch allergrößter Beliebtheit erfreut: Aluminium ist zunächst einmal als Metall unverzichtbar geworden und deshalb um uns herum überall zu finden: Fensterrahmen, Kochtöpfe, Auto-Karosserien, Flugzeuge, Werkzeuge, Lineale (usw.) bestehen aus dem Leichtmetall.
Als unedles Metall setzt Aluminium seine inkriminierten Ionen frei. Nun ja, das Metall bildet zwar eine äußere Schicht aus widerstandsfähigem Oxid/Hydroxid aus, was weitere Angriffe durch O2/H2O unterbindet („Passivierung“). Aber das gilt nur solange, wie der pH-Wert der Umgebung neutral ist. In Laugen oder in Säuren zersetzt sich das Oxid/Hydroxid rasch. Deshalb wirkt schon das Berühren mit schwitzigen Händen zersetzend…
Zur Erklärung der Zersetzung gehen wir vereinfachend vom Aluminium-Hydroxid aus, das sich ja auch aus dem Oxid bildet. Vereinfacht kann man das Reaktionsgeschehen so formulieren:
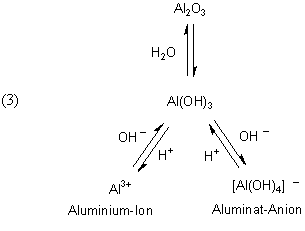
Einen genaueren Einblick in die chemischen Abläufe, die auf Komplexbildungs-Gleichgewichten basieren, gibt die folgende Übersicht. So liegt Al-Hydroxid in neutraler, wässriger Lösung als Aqua-Komplex [Al(OH3)(H2O)3] vor.

Der Komplex im neutralen pH-Bereich ist ungeladen und flockt daher aus. Die anderen Komplexe sind wasserlöslich und bilden Kationen bzw. Anionen.
|
Versuch 2: Amphoterie von Al-Hydroxid Wir benötigen ein Reagenzglas und Tropfpipetten und als Chemikalien die Lösung eines Aluminiumsalzes (z. B. Acetat oder Alaun) (w = 1 %), Natronlauge (c = 1 mol/l) (C), Salzsäure (c = 1 mol/l) (C), Universalindikator-Papier.
Ergebnisse
|
Einen Stoff mit derartigen Eigenschaften nennt man „amphoter“ (gr. amphoteros, auf beiderlei Art).
Weshalb sollte man das alles wissen? Viele Lebensmittel werden in Alu-Schalen oder wie Pausenbrote in Alu-Folie verpackt. Lebensmittel sind im Allgemeinen alles andere als pH-neutral. Man denke nur an die Salate. Außerdem werden Lebensmittel in Alu-Schalen sogar gegrillt, also erhitzt. Das fördert die Zersetzung der Passivierungsschicht.
(In diesem Zusammenhang ist es erwähnenswert, dass dem Vernehmen nach am Hofe von Napoleon III. von Alu-Geschirr und mit Alu-Besteck gespeist wurde – das Metall war damals gerade besonders kostbar und galt deswegen als hipp. Die niedrigeren Ränge am französischen Kaiserhof mussten sich weiterhin mit billigem Goldgeschirr begnügen…)
Leute, die auf Al-haltige Deos verzichten, müssen also konsequenterweise auch bei Al-Gegenständen Reißaus nehmen…
Und neuerdings das: Die Kosmetik-Industrie wirbt mit Tonerde in hautreinigenden Gesicht-Cremes und Pickelsalben!
Tonerde? Die kommt uns bekannt vor. Im Chemielexikon steht: Tonerde ist nichts anderes als Aluminiumoxid. Was hat Aluminium-Oxid mit Ton oder mit Erde zu tun?
Erden war früher die Bezeichnung für Oxide, die beim Erhitzen schrumpften – wie der irdene Ton beim Brennen.
Ton ist ein Bestandteil des Erdbodens. Er besteht aus Tonmineralien. Darunter versteht man Verwitterungsprodukte von Feldspäten wie dem Kalifeldspat K[AlSi3O8].
Allen Tonmineralien ist gemeinsam, dass sie Silikate sind, die im Kristallgitter anstelle von einigen Si-Atomen Atome von Al enthalten. Man spricht von Alumo-Silicaten. Bei deren Abbau entsteht unter anderem Aluminium-Oxid, also Tonerde.
Beispiele für Tonmineralien sind Kaolinit sowie Montmorillonit und Vermiculit, aber auch die natürlich vorkommende Tonmineralienmischung namens Bentonit. Diese sind allesamt wichtige Bodenmineralien. Sie zeichnen sich durch gute Wasserspeicherung und durch hohe Adsorptionsfähigkeit aus. Dazu verfügen sie über die Eigenschaften von Ionenaustauschern.
Leider sind auch sie nicht stabil. Deshalb setzen auch sie Aluminium-Ionen frei – wenn auch in geringem Umfang. Letztlich bestimmen den Umfang der Freisetzung die Häufigkeit der Anwendung und die Dauer der Einwirkung.
Nun müsste man wissen, was die Kosmetik-Industrie unter der „Tonerde“ versteht, mit denen sie wirbt. Handelt es sich um klassisch-chemische Tonerde, so ist das ein Aluminiumoxid/hydroxid-Gemisch, das leicht Aluminium-Ionen freisetzt. Wenn aber Tonmineralienmischungen wie das in vielen Kosmetika schon seit langem enthaltene Bentonit gemeint sind, also natürliche Tone, die in der Erde vorkommen, so ist das weniger schlimm. Die sind vergleichsweise stabil.
Haben wir trotzdem bald einen neuen Hype? Macht Tonerde-haltige Kosmetik Hautkrebs? Oder Hirn-Tumore? Warten wir ab…
Zur Beruhigung sei gesagt: Früher nutzten die Menschen ein wichtiges Hausmittel: Essigsaure Tonerde. (Sie tun das auch heute noch in steigendem Maße.)
Das ist nichts anderes als eine Bereitung von Al2O3 in Essigsäure (HAc), also letztlich Aluminium-Acetat. Essigsaure Tonerde riecht auch dementsprechend…
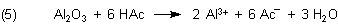
Früher mischte man zur Herstellung von essigsaurer Tonerde Töpfer-Ton mit Haushaltsessig – man erhielt also ein wahres Naturprodukt. Diese Pampe strich man z. B. auf Entzündungen (antimikrobielle Wirkung). Wundheilungen sollen damit schneller verlaufen. Als saures Histamin-Antidot lindert aufgetragene essigsaure Tonerde die Auswirkungen von Insektenstichen (vor allem von Wespen und Bienen). Auch bei vielerlei Magen- und Verdauungsproblemen hat man dieses Volksmedikament geschluckt.
Über negative Langzeit-Wirkungen dieses Aluminiumsalzes ist wenig bekannt… Aber vielleicht wurden die Leute früher einfach nicht alt genug, um etwas Entsprechendes zu bemerken.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 28. September 2019, Fritz Meiners