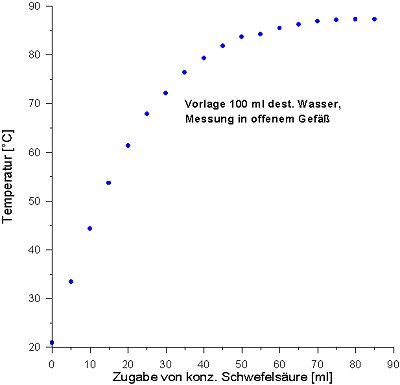
Graphik 1: Temperaturzunahme bei Zugabe von Schwefelsäure
zu Wasser (Versuch 1) |
|
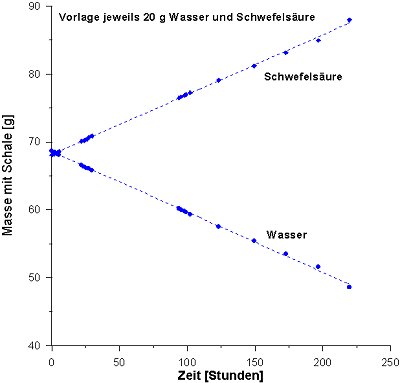
Ergebnisse der Versuche zur Verdünnung der Schwefelsäure

Graphik 1: Temperaturzunahme bei Zugabe von Schwefelsäure
zu Wasser (Versuch 1) |
|
Lies zur Graphik 1 auch den folgenden Text!
Warum erreicht die Kurve in der Graphik 1 einen Sättigungswert?
Jeder erwartet, dass die Kurve linear verläuft. Für die Abweichung gibt es drei
Gründe:
| 1. | Primär bildet sich das optimale Hydrat H2SO4 · 8 H2O unter größtmöglicher Energiefreisetzung. Deshalb ist zu Beginn die Steigung der Kurve am größten. Mit steigender Schwefelsäurezugabe nimmt der Wasservorrat ab; es bilden sich Schwefelsäurehydrate mit geringen Wasseranteilen; folglich wird die freiwerdende Energie immer geringer. |
| 2. | Schließlich finden sogar energiezehrende
Konkurrenzreaktionen um Hydratwasser statt; z. B.
H2SO4 · 8 H2O + H2SO4 ———> H2SO4 · 6 H2O + H2SO4 · 2 H2O /endotherm |
| 3. | Die zugegebene Säure ist kalt und kühlt das Reaktionssystem weiter ab. |