
"Leere" Batterie vom Leclanché-Typ.
Man erkennt in der mittleren und ganz besonders in der rechten Kammer Korrosionsspuren
(Foto: Daggi)
Wir erklären hier das klassische Element, das auf der Basis von Zink
arbeitet. Für Aluminium gilt Entsprechendes.
Das Element beruht primär auf der Auflösung eines unedlen Metalls durch eine Säure, also auf einer sehr einfachen chemischen Redox-Reaktion.
Zn + 2 H+ ———> Zn2+ + H2
Diese Reaktion können wir formal aufteilen.
Oxidation: Zn ———>
Zn2+ + 2 e-
Reduktion: 2 H+ + 2 e-
———> H2
Wenn du Reduktion und Oxidation in örtlich getrennten Bereichen ablaufen lässt, kann zwischen diesen ein Strom fließen:
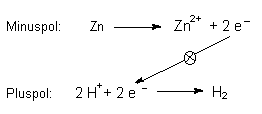
Diese Anordnung ist die eines Volta-Elements. Bei diesem wird in Schwefelsäure als protonenliefernden Elektrolyten eine Zinkplatte gegen eine Kupferplatte geschaltet. Die Entladung der Wasserstoff-Ionen findet an der Kupferplatte und nicht am Zink statt. Die Kupferelektrode spielt somit die Rolle eines Katalysators.
Wegen der Schwefelsäure war das Voltaelement recht unhandlich und konnte nicht überall hin mitgenommen werden. Erst Leclanché gelang es, die Bedingungen für diese Redox-Reaktion so zu gestalten, dass er eine geschlossene Trockenbatterie erhielt. Als festen Elektrolyten und Protonenspender wählte er Ammoniumchlorid, bekanntlich ein saures Salz.
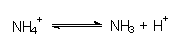
Die Freisetzung von Wasserstoff wird unterbunden, indem man ihn im Moment des Entstehens zu Wasser rückoxidiert. Die vielen Varianten dieses Batterietyps unterscheiden sich nur darin, wie der Wasserstoff rückoxidiert wird. Hier zwei Beispiele:
1 Oxidationsmittel Braunstein (Mangandioxid, MnO2):
2 H+ + 2 e- + 2 MnO2 ———> Mn2O3 + H2O
Man spricht hier von einer Zink-Mangan-Zelle.
2 Oxidationsmittel Sauerstoff:
Der Wasserstoff wird an einem mit Luft gesättigten Kohlestab entladen und rückoxidiert.
4 H+ + 4 e- + O2 ———> 2 H2O
(Zink-Kohle- oder Zink-Luft-Element).
In beiden Fällen spielt der Kohlestab die Rolle des Katalysators, an dessen Oberfläche die Wasserstoff-Ionen zunächst reduziert und anschließend unter Bildung von Wasser rückoxidiert werden.
Das störende Wasser wird durch das gebildete Mangan(III)-oxid oder durch Zink-Ionen chemisch als Hydrat- bzw. als Komplexwasser fixiert.
Mn2O3 + H2O ———> Mn2O3 · H2O
Zn2+ + 4 H2O ———> [Zn(H2O)4]2+
Dennoch verflüssigt sich der Inhalt des Elements mit der Zeit, da mehr Wasser entsteht als gebunden werden kann. Zu bedenken ist auch, dass der Zinkbecher nicht gleichmäßig, sondern punktuell zersetzt wird, also regelrecht korrodiert ("Lochfraß"). Die Batterie kann deshalb während des Betriebs sogar auslaufen.
Das Ammoniak, das aus dem Ammoniumchlorid entsteht, wird ebenfalls von den Zink-Ionen komplexartig gebunden; z. B.:
Zn2+ + 4 NH3 ———> [Zn(NH3)4]2+
(Es bilden sich Mischkomplexe mit Wasser- und Ammoniak-Molekülen als Liganden.)
Alle Reaktionen laufen natürlich simultan ab. Deshalb werden die wesentlichen, bei der stromliefernden Redox-Reaktion ablaufenden Vorgänge durch folgende Gleichungen beschrieben:
Oxidation (Minuspol; Anode): Zn + 2 NH4+
———> [Zn(NH3)2]2+ + 2 e- + 2 H+
Reduktion (Pluspol; Kathode): 2 MnO2 + 2 H+
+ 2 e- ———> Mn2O3 · H2O
Redoxreaktion: Zn + 2 NH4+ + 2 MnO2 ———> [Zn(NH3)2]2+ + Mn2O3 · H2O
Du kannst die Gleichung des Redoxvorgangs auch in stark verkürzter Form unter Verwendung von Oxidationszahlen schreiben:
Zn0 + 2 MnIV ———> ZnII + 2 MnIII
Für Aluminium gilt entsprechend:
2 Al0 + 6 MnIV ———> 2 AlIII + 6 MnIII