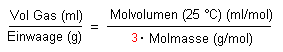
Lösung zu Versuch 1
Die Reaktionsgleichung bildet die Grundlage für unsere Berechnung:
3 PbO2 ———> Pb3O4 + O2
3 Mol Bleidioxid ergeben somit 1 Mol Sauerstoff.
Nun schätzen wir die zu erwartende Gasmenge ab:
Die Molmasse von Bleidioxid ist 239,2 g. Ein Mol Bleidioxid ergibt 1/3 Mol Sauerstoff oder
22412/3 ml Gas. Das gilt für Normalbedingungen wie 0 °C. Wir arbeiten aber bei
Zimmertemperatur. Als Faustregel gilt: Bei 25 °C erhöht sich das Volumen um ca. 10
%, genau auf 24465/3 ml.
Jetzt können wir durch einfache Verhältnisbildung sagen, wie viel Gas wir
für unsere spezielle Einwaage erwarten.
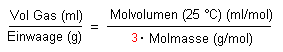
Haben wir z. B. 3 g Bleidioxid eingewogen, so erhalten wir:
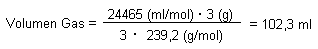
Das ist genau das, was in einen Kolbenprober hineinpaßt. Wir müssen jedoch zwei Kolbenprober anschließen, da sich das Gas bei dem Versuch auf etwa 500 °C erhitzt, also wesentlich mehr Platz benötigt.