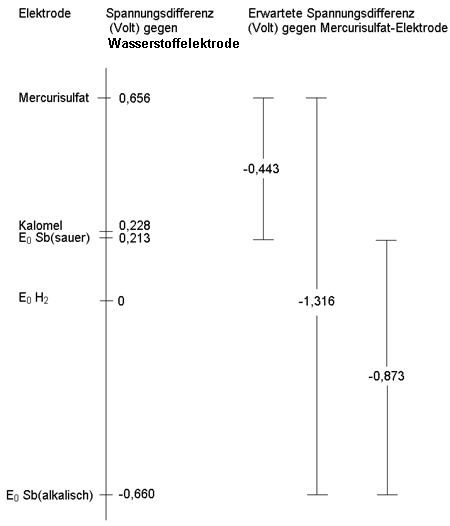
Potentialberechnung bei verschiedenen Bezugs-Elektroden
Die E0-Werte der üblichen Tabellen sind auf die Standard-Wasserstoffelektrode bezogen. Um sie mit der bei der Titration verwendeten Bezugselektrode wie z. B. der Mercurisulfatelektrode zu vergleichen, muss man deren Potential (E0 = 0,656 Volt bei gesättigter Kaliumsulfat-Lösung) berücksichtigen.
Es gilt allgemein:
E(gegen H2) = E(gemessen) + E(Bezug)
Hast du beispielsweise zu Beginn der Titration E = -0,51 V gegen die Mercurisulfatelektrode gemessen, so berechnet sich das Potential gegen die Wasserstoffelektrode zu
E(gegen H2) = -0,51 Volt + 0,656 Volt = 0,146 Volt
Die folgende Graphik, die die relative Lage der Potentiale zueinander verdeutlicht, zeigt diesen Zusammenhang:

Du siehst, dass die aus der Graphik entnommenen Werte in der Tendenz gut mit deinen Messwerten übereinstimmen. Dass die Übereinstimmung nicht vollständig ist, liegt unter anderem daran, dass die tabellierten E0-Werte anders bestimmt werden, so z. B. in 1molaren Lösungen der am Gleichgewicht beteiligten Ionen.
Berechne zur Übung, welche Werte du ungefähr erhalten würdest, wenn du eine
Kalomelelektrode verwendet hättest (E0 = 0,228 Volt).
Zeichne die entsprechende Graphik.
Berechne auch die Werte auf der Basis der Silberchlorid-Elektrode.
Deren Potential beträgt 0,198 Volt. Deine nach Versuchsteil 2 selbst hergestellte
Silberchloridelektrode (im Versuch) hat ein Potential von etwa 0,15 Volt.