
Einführung in die chemische Formelsprache und in die Herleitung
einer Reaktionsgleichung
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Die Einführung der chemischen Formelschreibweise und der erste Ansatz zur
Quantifizierung der Chemie im Unterricht erfolgen zu einem Zeitpunkt, wo im
Mathematik- sowie Physik-Unterricht bereits Formeln geschrieben und Messungen quantitativ
ausgewertet werden. Viele Schüler kennen auch schon in der Grundschule einfache
Formeln wie H2O oder C2H5OH. Deshalb ist es
merkwürdig, wenn zum Beispiel in NRW die Einführung in die chemische Formelschreibweise
erst in der 9. Klasse vorgesehen ist. Dabei ist die Formelschreibweise, wenn sie
behutsam eingeführt wird, für die Schüler auf eine besondere Art und Weise hilfreich:
In der Chemie werden Symbole für Modelle für nie Gesehenes (die Atome) verwendet,
die anders als in Biologie oder Physik nicht direkt nachprüfbar sind, sondern nur indirekt,
indem von äußeren Phänomenen und Gesetzmäßigkeiten auf den
inneren Aufbau der Materie und damit auf die Realität der Modellvorstellung geschlossen wird.
Zur Gewöhnung an das Modell des Aufbaus der Materie aus kleinsten Teilchen hat im
Chemieunterricht die Formelschreibweise in erheblichem Umfang beigetragen. Das gilt ganz
besonders dann, wenn den Schülern deutlich gemacht wird, dass eine Reaktionsgleichung für
den Chemiker eigentlich gar nicht die Reaktion zwischen Stoffen beschreibt, sondern letztlich
die Reaktion zwischen einzelnen Atomen (ausgedrückt in Elementsymbolen) bzw. Molekülen
(oder sonstigen Teilchengruppen, ausgedrückt in Formeleinheiten).
Die Formulierung von chemischen Vorgängen, die die Phantasie der Schüler stark
anregen, in abkürzender chemischer Schreibweise soll die Abstraktionsfähigkeit der
Schüler fördern und die Kinder schulen, Wichtiges von Unwichtigem zu unterscheiden
und das Wichtige zu behalten. Die Einführung der chemischen Formelsprache kann
deshalb erzieherisch wirken. In diesem Gegensatz (Phantasieanregung, Schulung der
Abstraktionsfähigkeit) liegt vielleicht aber auch der Grund dafür, dass viele Schüler zwar
selber gerne chemische Versuche machen, dem Fach Chemie aber eher ablehnend
gegenüberstehen.
Der sehr formale Lehrstoff muss deshalb durch exemplarische chemische Experimente
aufgelockert werden. Zunächst sollte ein Versuch am Anfang stehen, der
stöchiometrisch einfach verläuft, bei dem sich Elemente also im Verhältnis 1 : 1
umsetzen. Wir wählen hierzu eine Sulfidbildungsreaktion.
Das Einführen von Indices und stöchiometrischen Faktoren wird mit einem weiteren
Reaktionssystem (Oxidbildungsreaktion) geübt.
1 Lernziele
A. Groblernziele:
Die Schüler sollen einfache chemische Vorgänge mit der international verständlichen
chemischen Symbolschreibung und Formelsprache beschreiben können.
B. Feinlernziele:
Die Schüler sollen
| 1. | ein einfaches chemisches Experiment planen und durchführen können, |
| 2. | für einfache chemische Reaktionen eine Wortgleichung aufstellen können, |
| 3. | dabei auch die Energieänderung mit einbeziehen, |
| 4. | erklären können, was Symbole sind und warum diese der internationalen Verständigung dienen, |
| 5. | eine einfache chemische Reaktionsgleichung aufstellen können, |
| 6. | den Unterschied zwischen einer chemischen und einer mathematischen Gleichung erklären können, |
| 7. | darlegen können, dass ein chemisches Symbol (bzw. eine Formel) nicht nur die Abkürzung eines Elementes ist, sondern auch ein Atom des betreffenden Elementes (bzw. ein Molekül der Verbindung) symbolisiert, |
| 8. | die Bedeutung von stöchiometrischen Faktoren und Indices erklären können. |
2. Lernausgangslage
In vorhergehenden Stunden wurden nach Einführung der Teilchenvorstellung die
Begriffe "Atom" und "Element" sowie "Molekül" und "Verbindung" ausführlich behandelt.
Weiter wurde auf einige grundlegende chemische Reaktionen (Oxidation von Metallen
und Nichtmetallen) eingegangen, bei denen erste chemische Verbindungen z. T. von
den Schülern selbst hergestellt wurden. Die Schüler kennen die Bedeutung der Begriffe
"Modell" und "Symbol". Das Gesetz von der Erhaltung der Masse ist bekannt.
3. Sachanalyse
Eine chemische Reaktionsgleichung (RG) ist weit mehr als nur eine abkürzende
Reaktionsbeschreibung. Sie kann unter vier Gesichtspunkten verstanden werden, bei
denen der Abstraktionsgrad zunimmt. Das sei am Beispiel der Zink/Schwefel-Reaktion
erläutert:

| 1. | Eine RG ist die abkürzende Beschreibung einer chemischen
Reaktion zwischen Stoffen.
Man schreibt sie mit international verständlichen Symbolen. |
| 2. | Eine RG beschreibt die chemische Reaktion zwischen einzelnen
Atomen bzw. Molekülen.
Jedes Symbol steht für ein Atom. Jede Formel steht für ein Molekül (wie CO2) oder für eine Formeleinheit (wie NaCl). Die stöchiometrischen Faktoren sowie Indices lassen Rückschlüsse auf Wertigkeit (wie bei Cu2O, H2O) bzw. auf das Vorliegen der beteiligten Elemente (wie bei O2, P4) zu. |
| 3. | Eine RG beschreibt die Stoffumsätze in Mengen vom Umfange
der Loschmidtschen Zahl.
Ein Symbol und eine Formel stehen jeweils für die Stoffportion 1 Mol. |
| 4. | Eine RG beschreibt ein (thermodynamisch) geschlossenes System.
Aus diesem Grunde ist auch die Energieänderung mit einzubeziehen. An den Reaktionspfeil können die Reaktionsbedingungen geschrieben werden. |
Hinzu kommt noch der Unterschied zwischen einer mathematischen und einer
chemischen Gleichung.
Bei einer mathematischen Gleichung steht links und rechts wertmäßig das Gleiche.
Bei einer chemischen Reaktionsgleichung stehen links und rechts andere Stoffe. Nur
die Anzahl der Atome ist gleich.
(Diese Sachanalyse gibt es auch als Folie.)
4. Methodisches Vorgehen
Ausgehend von der Wiederholung des Lehrstoffes der vorangegangenen Stunde wird
für eine der durchgeführten Reaktionen zunächst das Reaktionsschema, dann die
Wortgleichung aufgestellt.
Nun wird das Problem aufgeworfen: Wie kann man einem Ausländer, der unsere
Sprache nicht versteht oder der unsere Schrift nicht lesen kann, diese chemische
Reaktion erklären?
Der Lehrer kann die Gleichungen in Englisch übersetzen; motivierender wäre es, wenn
Ausländerkinder in der Klasse den Text in ihrer Sprache unter die Wortgleichung
schreiben könnten.

Bild 1 (Foto: Daggi)
Als Grundlage der gemeinsamen Erarbeitung der chemischen Reaktionsgleichung wird
ein spektakulärer Lehrer-Versuch (Zink/Schwefel-Reaktion)
durchgeführt. Diese Reaktion bietet sich hier auch an, weil sie als Einatomreaktion abläuft
und deshalb besonders einfach zu formulieren ist. Da das Hauptziel der Unterrichtsstunde
nicht in der genauen Erarbeitung der Sulfidbildung aus den Elementen (z. B. durch Analyse
der Reaktionsprodukte) liegt, wird der Lehrer mitteilen, welcher Stoff entstanden ist.
Die Beschreibung des Versuches durch die Schüler wird zunächst im Erzählstil erfolgen
und führt zum Reaktionsschema.
Zink und Schwefel reagieren unter Wärme- und Lichtfreisetzung zu Zinksulfid
Der Lehrer wird dabei auf die Einhaltung einer chemischen Terminologie achten.
Die Schüler erarbeiten dann die Wortgleichung und werden dabei auf die wichtige Rolle der Energie (als Reaktionsbedingung und als Reaktions-"Produkt") hingewiesen.
Zink + Schwefel ———> Zinksulfid + Energie
Mit Kugelmodellen soll u. a. auch die Vorstellung vom Teilchenkonzept vertieft werden.

Anstelle der Kugeln bietet der Lehrer dann Modelle aus Filterpapierblättern an. Die können grau und gelb bemalt werden. Sie können aber auch ohne Einfärbung gleich mit den Worten der Wortgleichung beschriftet werden. Die Blätter werden (zum Beispiel mit Pritt-Hafties) an der Tafel befestigt. Beim Zinksulfid werden zwei überlappende Scheiben genommen. Man kann sie auch mit einem Hefter zusammenklammern. Wichtig: Man nimmt zusätzlich ein rechteckiges Blatt, auf dem das Wort "Energie" steht.
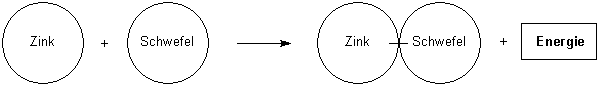
Nun kann an dieser Stelle die Frage nach dem Verstehen des Textes durch Ausländer eingegangen werden. Da ist es von Vorteil, wenn Ausländerkinder in der Klasse sind, die den Text übersetzen können. Hier ist das Reaktionsschema in verschiedenen Sprachen und Schriften dargestellt:
Zink und Schwefel reagieren zu Zinksulfid und Energie
Englisch:
Zinc and sulphur react to sulfide of zinc and energy
Französisch:
Zinc et soufre réagissent à la sulfure de zinc et énergie
Kreolisch (Mauritius):
Zink ek soufre reazir en silfir zink ek l'énerzi
Madegassisch:
Vifotsy ampiana Sofra manome ZnS ampiana Angovo
Spanisch:
Cinc y azufre reaccionan a sulfuro de cinc y energia
Portugiesisch:
Zinco e enxofre reagem em sulfito de zinco mais energia
Niederländisch:
Zink en zwavel reageren tot zinksulfide en energie
Dänisch:
Zink og svavel reagerer til zinksulfid og energi
Schwedisch:
Zink och svavel reagerar till zinksulfid och energi
Finnisch:
Sinkin ja rikin reagoidessa muodostuu sinkkisulfidia ja energiaa
Altgriechisch:
(ohne Erwähnung der Energie)
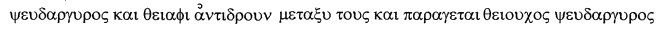
Polnisch:
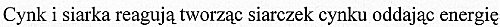
Russisch:
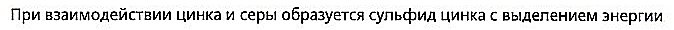
Ukrainisch:
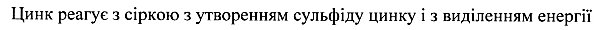
Kroatisch (Hrvatski):
Cink i sumpor jednako cinksulfid i energija
Rumänisch:
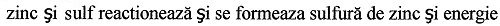
Bulgarisch:
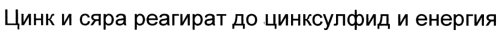
Türkisch:
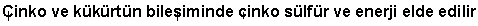
Chinesisch:
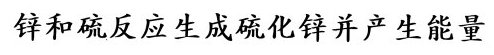
Arabisch:

Persisch:

Wir müssen uns um allgemein verständliche Symbole kümmern. Die Schüler erarbeiten
gemeinsam mit dem Lehrer die Bedeutung der Symbole für die internationale
Verständigung. Hier sei an die Piktogramme von Gefahrensymbolen erinnert
oder an Verkehrszeichen.
So wie die Piktogramme beruhen auch die Symbole für die chemischen Elemente auf
internationalen Absprachen.
Nun werden statt der deutschen Worte abkürzende Elementsymbole verwendet.
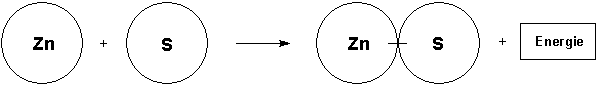
Von diesen Modellen wird abstrahiert, indem statt der angeklebten Papierscheiben die endgültige Reaktionsgleichung an die Tafel geschrieben wird.

Dabei gewöhnen sich die Schüler auch gleich daran, die Reaktionsbedingungen über den Pfeil zu schreiben, hier also zum Beispiel:

Die Schüler lernen, dass ein Symbol für ein Atom, eine Formel für ein Molekül oder für eine Formeleinheit steht.
Anschließend wird unter Rückbesinnung auf das Gesetz
von der Erhaltung der Masse der Unterschied zu einer mathematischen Gleichung deutlich
herausgestellt.
Bei einer mathematischen Gleichung steht links
und rechts wertmäßig das Gleiche.
Bei einer chemischen Reaktionsgleichung stehen
links und rechts andere Stoffe. Nur die Anzahl der Atome ist gleich.

Bild 2 (Foto: Daggi)
Ein Lehrerversuch (Verbrennen von Magnesium; Schutzbrille aufsetzen wegen der UV-Strahlung!) soll
nicht nur die Stunde auflockern und den Lehrstoff vertiefen. Denn anhand dieser Reaktion kann
man in die Rolle der stöchiometrischen Faktoren und der Indices einführen.
Das Reaktionsschema ist:
Magnesium und Sauerstoff reagieren unter Hitze- und Lichtentwicklung zu Magnesiumoxid
Dann folgen die Papierscheibchenmodelle, zunächst die mit dem Volltext.
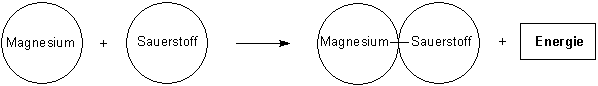
Für die Interessierten ist hier der Text in chinesischer Sprache und Schrift:

Nun beschriften wir Papierscheibchen mit den international verständlichen Symbolen.
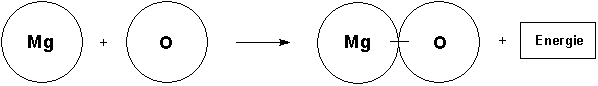
Nun teilt der Lehrer mit, dass das Element Sauerstoff nur molekular auftritt. Das wirft Probleme bei der Formulierung der Reaktionsgleichung auf: Wenn zwei Sauerstoffatome gekoppelt reagieren, müssen natürlich auch zwei Magnesiumatome beteiligt sein. Alle reagieren dann auch zu zwei Magnesiumoxid-Molekülen (besser: Formeleinheiten). Im Scheibenmodell werden zwei einzelne Magnesiumatome an der Tafel befestigt. Dazu kommt ein zusammengeklammertes Sauerstoffmolekül. Es werden zwei getrennt zusammengeklammerte Magnesiumoxid-Moleküle benötigt. Wichtig: Gegenüber der ersten Gleichung verdoppelt sich damit auch die Energie, so dass wir zwei Energie-Symbolblätter benötigen!
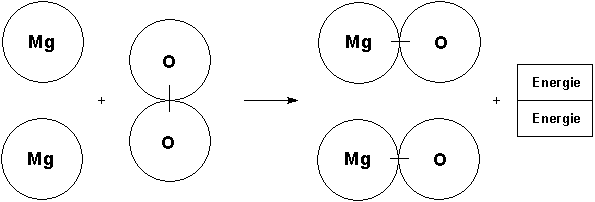
Es wird die Bedeutung der stöchiometrischen Indices und Faktoren erarbeitet. Die Faktoren haben nur im Zusammenhang mit einer chemischen Reaktionsgleichung Sinn.
Index, Indices
Zur Beschreibung des Aufbaus eines Moleküls oder einer Formeleinheit schreibt man die Zahl
der beteiligten Atome hinter das Elementsymbol; die 1 wird weggelassen.
Beispiele: ZnS, O2, MgO (oder andere, bekannte Stoffbeispiele)
Faktoren
Sind an einer chemischen Reaktion mehrere Moleküle der gleichen Art beteiligt, so schreibt man
deren Zahl vor das Symbol oder die Formeleinheit; die 1 wird weggelassen.
Beispiele: Zn, S, ZnS, 2 Mg, O2, 2 MgO (oder andere, bekannte Reaktionsbeispiele)
Die endgültige Reaktionsgleichung ist dann:

Ein Blick in die Geschichte der Chemie rundet die Einheit ab: Auch die Alchimisten hatten früher eine eigene Symbolschrift entwickelt. Diese diente aber nicht der internationalen Kommunikation, sondern ausschließlich der Geheimniskrämerei und war deshalb für den Rest der Gesellschaft unverständlich. Um das zu verdeutlichen, bedient man sich der folgenden Folie.
| Klick mich an! |
 |
Man kann nun überlegen, inwieweit man die Aussagen der Sachanalyse für die Schüler
als Lernsätze formuliert. Dazu sollte bald auch auf Folgendes hingewiesen werden: Für
den Chemiker ist ein Symbol in einer Reaktionsgleichung eine Stoffportion. Ob man
je eine Kugel bzw. ein Atom von Zink oder Schwefel reagieren lässt, ob man
hundert oder eine Million Atome nimmt: Für den Chemiker ist das egal. Nur wird für
ihn erst bei einer hohen Zahl wie 6 · 10 23 Atomen der Ansatz
wiegbar, weil die Atome so klein sind. Wir lernen daraus: Eine Reaktionsgleichung
beschreibt die Stoffumsätze in Mengen vom Umfange der Loschmidtschen Zahl. Ein Symbol
und eine Formel stehen deshalb jeweils für die Stoffportion 1 Mol oder einem Vielfachen davon.
Da die Atome verschiedener Elemente sich in ihrer Masse (Atomgewicht) unterscheiden, wird
die Rolle der als Teilchenzahl definierten Stoffportion für die Einwaage von Edukte und die
Wägung der Produkte deutlich. So können wir zum Molbegriff überleiten.
Deshalb sollte anschließend in die quantitativen Gesetze der Chemie eingeführt werden (-> Webseite).
Wie man kompliziertere Redox-Gleichungen schrittweise herleitet, zeigen wir hier.